הטבלה המחזורית

הטבלה המחזורית או המערכה המחזורית (באנגלית: Periodic table of elements או Periodic table), המכונה גם הטבלה המחזורית של מנדלייב (באנגלית: Mendeleev's periodic table) או טבלת מנדלייב (באנגלית: Mendeleev table), היא שיטת מיון (טקסונומיה) הממיינת את כל היסודות לפי המספר האטומי של האטומים שלהם.[א]
המספרים האטומיים
בעת שנבנתה הטבלה, המספרים האטומיים היו לא יותר ממספרים סידוריים שניתנו ליסודות על-פי המשקל שלהם, אך 70 שנה מאוחר יותר פותחה תאוריה שהסבירה את הקשר בין המספר האטומי למבנה הפנימי של אטומי היסודות. המספר של יסוד בטבלה המחזורית נקרא המספר האטומי, והוא מציין את מספר הפרוטונים שבגרעין. מספר זה קובע את סוג האטום, לדוגמה לחמצן 8 פרוטונים בגרעינו. יסוד יסומן עם שמו ומסתו האטומית, לדוגמה האיזוטופ הנפוץ של ברזל יסומן כ-56Fe. מספרו האטומי 26, ומסתו המדויקת 55.935amu, הקרובה למספר הפרוטונים ועוד הנייטרונים (56).
בנוסף לפרוטונים נמצאים בגרעין נייטרונים, אשר אינם משפיעים על התכונות הכימיות של האטום אך משפיעים על מסתו ועל התכונות הגרעיניות שלו. אטומים בעלי אותו מספר אטומי אך מסה אטומית שונה נקראים איזוטופים שונים של אותו יסוד, והם נבדלים זה מזה רק במספר הנייטרונים.
מסת הנייטרונים שווה בקירוב למסת הפרוטונים. המסה האטומית היא המסה של האטום, הנמדדת ביחידות מסה אטומית מאוחדת (u) ושווה בקירוב לסך מסת הפרוטונים והנייטרונים.
גודל דומה למסה האטומית הוא מסה אטומית יחסית, שהיא המסה של היסוד משוקללת כפי שהוא מצוי בטבע, כלומר תערובת של איזוטופים שונים של היסוד על פי תפוצתם. גודל זה יחסי למסה מולרית, שהיא המסה של מול אחד של אטומים (6.022×1023 אטומים) של אותו יסוד כפי שהוא מצוי בטבע, ונמדדת בגרמים. המסה המולרית בגרמים שווה, על-פי ההגדרה, למסה האטומית היחסית ביחידות מסה אטומית.
חלוקות שונות של הטבלה המחזורית
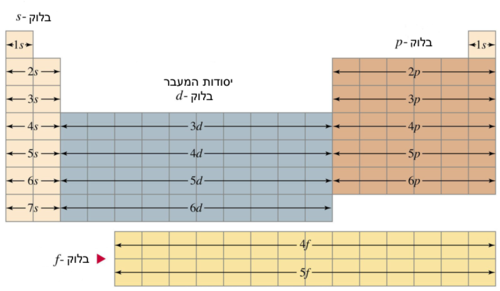
חלוקה לבלוקים
 ערך מורחב – אורביטל אטומי
ערך מורחב – אורביטל אטומי
האלקטרונים באטום מסודרים בקליפות, על פי תורת הקוונטים. הקליפות מציינות באופן מקורב את האנרגיה של האלקטרונים בהן ואת המרחק מהגרעין. בממוצע, בקליפה בעלת אנרגיה גבוהה יותר האלקטרונים רחוקים יותר מהגרעין. הקליפות מסומנות במספרים 1 עד 7 לפי רמת אנרגיה. הקליפות עצמן מחולקות לאורביטלים אטומיים לפי התנע הזוויתי של האלקטרונים בהן. האורביטלים מסומנים באותיות: s, p, d, f. אורביטלים שונים מציינים אנרגיה שונה: אורביטל s הוא בעל האנרגיה הנמוכה ביותר, אחריו p, וכן הלאה.
האלקטרונים באטום נמצאים באורביטל בעל האנרגיה הנמוכה ביותר, וכשהיא מתמלאת הם ממלאים את הרמה הבאה. מכאן נגזר גם המבנה של הטבלה המחזורית, והבלוקים הצבעוניים באיור.
| רמת אנרגיה | אלקטרונים (מקסימום) |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 8 |
| 4 | 18 |
| 5 | 18 |
| 6 | 32 |
| 7 | 32 |
קליפה s יכולה להכיל 2 אלקטרונים, ולכן שני היסודות הראשונים בכל שורה משויכים אליה (שורה ראשונה מתאימה לקליפה 1s שורה שנייה 2s וכן הלאה). קליפה p יכולה להכיל עד שישה אלקטרונים, ומכילה את ששת הטורים האחרונים (13–18). קליפה d מכילה עד 10 אלקטרונים ומשויכות אליה מתכות המעבר וכן יסודות הטור 12: אבץ, קדמיום וכספית (שאינם מתכות מעבר מכיוון שקליפה d שלהם מלאה בכל מצבי החמצון). קליפה f מכילה עד 14 אלקטרונים ומכילה את הלנתנידים והאקטינידים.
חלוקה לשלוש קבוצות עיקריות
אחת החלוקות החשובות של הטבלה המחזורית היא לשלוש קבוצות:
- מתכות – יסודות היוצרים מוצק גבישי בטמפרטורת החדר (מלבד כספית). מתאפיינות בדרך כלל במוליכות חשמלית טובה ובמראה מבריק (אם פניהן נקיים ולא מחומצנים). מבחינה כימית נוטים לקשר מתכתי או לקשר יוני כיון חיובי.
- יסודות אל-מתכתיים – יסודות אשר אינם מתכתיים, בדרך כלל אינם מוליכים (מלבד פחמן במצבים מסוימים), יכולים להיות גזיים, נוזליים או מוצקים בטמפרטורת החדר. מבחינה כימית נוטים לקשר קוולנטי, לקשר יוני כיון שלילי, או לא ליצור קשר כלל (גזים אצילים).
- מתכות למחצה – קבוצת היסודות שבין מתכות לאל-מתכות. ליסודות בקבוצה תכונות אשר אינן מסווגות אותם בבירור כמתכת או אל מתכת. חלקן מוליכות למחצה, לדוגמה סיליקון וגרמניום, כלומר אינן מוליכות חשמל במצב רגיל אך מוליכות עם זיהום בריכוז נמוך או הוספת אנרגיה חיצונית (באמצעות אור או חימום).
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | קבוצה | ||
| מחזור | ||||||||||||||||||||
| 1 H |
2 He |
1 | ||||||||||||||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2 | ||||||||||||
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
3 | ||||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
4 | ||
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
5 | ||
| 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
6 | ||
| 87 Fr |
88 Ra |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
7 | ||
| * לנתנידים | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** אקטינידים | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
| מתכות | מתכות למחצה | יסודות אל-מתכתיים |
חלוקה לקבוצות ומחזורים
היסודות בטבלה המחזורית מסודרים בצורה מיוחדת, התואמת את סידור האלקטרונים שלהם (הקונפיגורציה האלקטרונית), ומכאן – את תכונותיהם הכימיות:
- כל אחת מהשורות נקראת מחזור. המחזור הראשון (העליון) מכיל רק שני יסודות (הליום ומימן) המחזיקים ב מספרים האטומיים 1 ו-2. מספר המחזור מעיד על מספר קליפות האלקטרונים סביב גרעין האטום בשורה. כך לאטומים במחזור הראשון יש רק קליפת אלקטרונים אחת, היות שהקליפה הראשונה יכולה להכיל רק 2 אלקטרונים לכל היותר.
- ליסודות הנמצאים באותה שורה יש מספר זהה של קליפות אלקטרונים, הנעים במסלולים ובצורות שונות, תלוי ברמת האנרגיה, במגנטיות ובגודל שלהם, כשהקליפה החיצונית של היסודות בקצה השמאלי של הטבלה מכילה אלקטרון אחד, ואילו קליפת היסודות בקצה הימני מכילה 8 אלקטרונים (המספר המקסימלי האפשרי; כלומר, קליפתם מלאה לגמרי באלקטרונים). לדוגמה, ליתיום וניאון מכילים שניהם שתי קליפות אלקטרונים, כיוון ששניהם מצויים בשורה השנייה של הטבלה. הקליפה החיצונית של ליתיום מכילה אלקטרון אחד, וזו של ניאון – 8 אלקטרונים. (יוצאת דופן היא השורה הראשונה, בה להליום, היסוד האחרון בשורה, רק שני אלקטרונים, משום שהקליפה הראשונה יכולה להכיל רק שניים). האלקטרונים בקליפה החיצונית מכונים "אלקטרוני ערכיות".
- ליסודות הנמצאים באותו הטור (מכונה בהקשר זה קבוצה) יש מספר זהה של אלקטרונים בקליפה החיצונית. היות שלמספר האלקטרונים בקליפה החיצונית השפעה מכרעת על התכונות הכימיות של היסוד, מגלים שלכל היסודות באותה קבוצה תכונות כימיות דומות, והם מהווים ברוב המקרים קבוצה מוגדרת בעלת שם (לדוגמה הלוגנים, מתכות אלקליות, גזים אצילים, ועוד). לכלל זה (בנוגע למספר האלקטרונים בקליפה החיצונית) יש יוצאים מן הכלל במתכות המעבר.
לטבלת מנדלייב כמה חסרונות, העיקרי שבהם הוא הקושי לתאר באמצעותה את תכונותיהן של מתכות המעבר. חלק ניכר ממתכות המעבר מובאות כנספח לטבלה, משום שאין אפשרות לכלול אותן בתוכה. כמו כן היסוד מימן חסר התכונות המתכתיות מופיע על-פי הטבלה בטור המתכות האלקליות שאינו מתאים לו מבחינת תכונותיו.
- טבלאות מחולקות לקבוצות ומחזורים
טבלה בלי לנתנידים ואקטינידים וטבלה נפרדת ללנתנידים ולאקטינידים:
| משפחה כימית ← | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| מחזור ↓ | ||||||||||||||||||||
| 1 | 2 He |
1 H | ||||||||||||||||||
| 2 | 10 Ne |
9 F |
8 O |
7 N |
6 C |
5 B |
4 Be |
3 Li | ||||||||||||
| 3 | 18 Ar |
17 Cl |
16 S |
15 P |
14 Si |
13 Al |
12 Mg |
11 Na | ||||||||||||
| 4 | 36 Kr |
35 Br |
34 Se |
33 As |
32 Ge |
31 Ga |
30 Zn |
29 Cu |
28 Ni |
27 Co |
26 Fe |
25 Mn |
24 Cr |
23 V |
22 Ti |
21 Sc |
20 Ca |
19 K | ||
| 5 | 54 Xe |
53 I |
52 Te |
51 Sb |
50 Sn |
49 In |
48 Cd |
47 Ag |
46 Pd |
45 Rh |
44 Ru |
43 Tc |
42 Mo |
41 Nb |
40 Zr |
39 Y |
38 Sr |
37 Rb | ||
| 6 | 86 Rn |
85 At |
84 Po |
83 Bi |
82 Pb |
81 Tl |
80 Hg |
79 Au |
78 Pt |
77 Ir |
76 Os |
75 Re |
74 W |
73 Ta |
72 Hf |
* | 56 Ba |
55 Cs | ||
| 7 | 118 Og |
117 Ts |
116 Lv |
115 Mc |
114 Fl |
113 Nh |
112 Cn |
111 Rg |
110 Ds |
109 Mt |
108 Hs |
107 Bh |
106 Sg |
105 Db |
104 Rf |
** | 88 Ra |
87 Fr | ||
| * לנתנידים: | 71 Lu |
70 Yb |
69 Tm |
68 Er |
67 Ho |
66 Dy |
65 Tb |
64 Gd |
63 Eu |
62 Sm |
61 Pm |
60 Nd |
59 Pr |
58 Ce |
57 La |
|||||
| ** אקטינידים: | 103 Lr |
102 No |
101 Md |
100 Fm |
99 Es |
98 Cf |
97 Bk |
96 Cm |
95 Am |
94 Pu |
93 Np |
92 U |
91 Pa |
90 Th |
89 Ac |
|||||
טבלה עם הלנתנידים והאקטינידים במקומם:
| הטבלה המחזורית | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| סדרות כימיות בטבלה המחזורית | ||||
|---|---|---|---|---|
| מתכות אלקליות | מתכות אלקאלי-עפרוריות | אקטינידים | לנתנידים | מתכות מעבר |
| מתכות מעבר עמידות | מתכות למחצה | יסודות אל-מתכתיים | הלוגנים | גזים אציליים |
| קידוד צבעים למספרים האטומיים: |
| שחור - יסודות מוצקים בטמפרטורת החדר; כחול - נוזליים, אדום - גזיים. אפור - לא ידוע. |
| מסומנים בקווקוו תכול - יסודות שאינם מופיעים בטבע והופקו באופן מלאכותי בלבד, רובם מוצקים בטמפרטורת החדר, פרט לקופרניקיום (יסוד מספר 112) ואוגאנסון (יסוד מספר 118). |
 |
 |
תצורות אלטרנטיביות לסידור היסודות
- כיוון שעומד היגיון מאחורי סידור הטבלה, ובכלל במהות היסודות השונים לפי סדר עולה במספר אטומי, לעיתים מעוצבות צורות אלטרנטיביות להצגת היסודות[1].
- ניתן למצוא גם צורות אינפוגרפיות שונות לטבלה.
- יש טבלאות המסודרות בצורה הרגילה, אך במיקום היסודות יש גם תמונה (אם אפשרית) של היסוד בטמפרטורת החדר[2], או של שימוש נפוץ באותו יסוד[3].
שיטות מיון היסודות

בשנת 1865, ארבע שנים טרם הציע מנדלייב את הצעתו, הציע כימאי אנגלי בשם ג'ון ניולנדס לסדר את היסודות בטבלה לפי משקלם האטומי ולפי סדר לו קרא 'חוק האוקטבות' שהיה שאול מאוקטבה מוזיקלית. לפי הסידור הזה כל היסודות חולקו על ידי ניולנדס לשמונה משפחות ומכאן הגיע שמו של החוק שקבע. הכימאי הרוסי דמיטרי מנדלייב גילה מחזוריות בתכונות הכימיות של היסודות, כאשר הם מסודרים מן הקל אל הכבד, וב-1869 פרסם את הטבלה הקרויה על שמו. בתקופה שבה הציע מנדלייב את שיטתו הוצעו גם שיטות מיון נוספות, לדוגמה שיטה שפותחה על ידי גוסטבוס דטלף הינריכס. טבלת מנדלייב נחשבת לשיטה המוצלחת ביותר, שכן הניבויים שלה הם המדויקים ביותר. מנדלייב, באמצעות הטבלה שבנה, הניח את התשתית לתאוריית התורה האטומית. הוא הצליח למצוא קשר בין צפיפות היסודות לאופי התגובה שלהם בתהליכים כימיים. את הגילוי הזה הוא ניצל לפיתוח מודל מתמטי שמאפשר ניבוי של תכונות היסודות על פי צפיפותם. יסודות בולטים שטבלת מנדלייב ניבאה הם סקנדיום, גליום וגרמניום, שלא היו ידועים בעת שנערכה, והתאימו במדויק למקומות החסרים בטבלה ולתכונות המצופות לפי המקום.
בתרבות הפופולרית
הטבלה המחזורית מהווה השראה לטבלאות אחרות של אובייקטים מתחומים שונים שאינם קשורים לכימיה, לדוגמא פונטים[4].
ראו גם
לקריאה נוספת
- סם קין, הכפית הנעלמת - הקסם המסתורי של הטבלה המחזורית, תרגם: עמנואל לוטם, הוצאת כנרת, זמורה-ביתן, 2013.
קישורים חיצוניים
- הטבלה אינה משקרת, באתר "הידען".
 רן לוי, הדרך אל הטבלה המחזורית, באתר "עושים היסטוריה" (שידור של הפודקאסט וטקסט מלא שלו)
רן לוי, הדרך אל הטבלה המחזורית, באתר "עושים היסטוריה" (שידור של הפודקאסט וטקסט מלא שלו)- טבלה מחזורית דינמית
- נעה לכמן ובועז קרני-הראל, הטבלה המחזורית של דמיטרי מנדלייב, באתר מדע גדול, בקטנה, 8 בפברואר, 2016
- כתבות על הטבלה המחזורית באתר מכון דוידסון | מדע לילדים – הטבלה המחזורית | יסודות חדשים בטבלה המחזורית (הקישור אינו פעיל) | היסודות החדשים – שלב השמות | מה הסידור ה'נכון' של הטבלה המחזורית? (הקישור אינו פעיל) | למה אנרגיית היינון איננה במגמה ברורה בטבלה המחזורית? | הקרב על הטבלה המחזורית
- הטבלה המחזורית, באתר אנציקלופדיה בריטניקה (באנגלית)
ביאורים
- ↑ נהוג לציין גם את הסמלים הכימיים אולם הם לקוחים מהשיום המדעי ולא משיטת מיון אלפביתית
הערות שוליים
הטבלה המחזורית42265526Q10693


