שיווי משקל תרמודינמי
שיווי משקל תרמודינמי הוא מצב של מערכות תרמודינמיות מאקרוסקופיות אותו מאפיינים ההיבטים הבאים:[1]
- בין המערכת לסביבה החיצונית ובתוך המערכת לא פועלים כוחות או מוֹמֶנְטֵי כוח שאינם מאוזנים. כלומר, סכום הכוחות על המערכת הוא 0.
- במערכת אין שינוי ספונטני של המבנה הפנימי כמו תגובה כימית או מעבר חומר בתוך המערכת.
- אין מעבר חום בין המערכת לסביבתה או בין חלקי המערכת. מכאן נובע כי טמפרטורת המערכת קבועה, אחידה ושווה לטמפרטורת הסביבה.
מערכות מאקרוסקופיות החוות שינויים מהסביבה החיצונית לעיתים מושפעות משינויים אלו באופן מתמשך. לאורך זמן, כאשר אין שינוי בסביבה החיצונית, השפעתם של השינויים הללו מתפוגגת והמערכת נוטה להגיע למצב פשוט ובלתי תלוי בהיסטוריה שחוותה. מצב זה מוגדר כמצב שיווי המשקל התרמודינמי של המערכת. כלומר, על פי הגדרה, מצב שיווי המשקל התרמודינמי של המערכת בלתי תלוי בזמן.[2] במצב זה, המערכת נמצאת בשיווי משקל תרמי, מכני וכימי.
תחת תנאים קבועים, המערכת התרמודינמית שואפת להגיע למצב שיווי המשקל שלה. כאשר המערכת מגיעה למצב זה, היא נוטה להישאר במצב זה מבחינה מאקרוסקופית. במקרה של שינוי בתנאים החיצוניים המשפיעים על המערכת, מצב שיווי המשקל של המערכת יכול להשתנות גם מבחינה מאקרוסקופית.
שיווי משקל תרמודינמי מתאר את המצב המאקרוסקופי של המערכת, ומצבים מיקרוסקופיים רבים יכולים להוביל למצב זה. מבחינה מאקרוסקופית מצב המערכת קבוע, והדבר מתבטא בכך שהגדלים התרמודינמיים המאפיינים את המערכת קבועים.
היסטוריה
התפיסה לפיה החומר עשוי מאטומים היא חלק אינטגרלי בפיתוח והבנת הרעיון של שיווי משקל תרמודינמי של מערכת. הרעיון הבסיסי, שלפיו החומר עשוי מחלקיקים קטנים ובלתי נראים לעין, מופיע בתרבויות עתיקות רבות כמו יוון והודו.[3] הרעיון הועלה בעקבות הגיון פיזיקלי ולא בעקבות ביסוס מחקרי או ביצוע ניסויים. מכיוון שהמושג הוכר באותה תקופה כאנטי דתי ואתאיסטי, הוא הפך לרעיון לא מקובל מבחינה חברתית ופוליטית. כתוצאה מכך, לא המשיך להתפתח אלא מאות שנים מאוחר יותר.
בעת המודרנית עלה בשנית מושג החלקיקים והתפתח מבחינה רעיונית, עם ניסויים שתמכו בו. בתחילת המאה ה-19, המדען ג'ון דלטון הציע שאטומים מתאחדים בתהליך כימי לכדי מולקולות.
בערך באותה תקופה החל להתפתח הרעיון של שיווי משקל. מושג זה נרקם עם פרסומם של מאמרים כמו "עקרונות בסיסיים על שיווי משקל ותנועה" של המדען לזאר קרנו, ומאמרים נוספים של גיבס והלמהולץ.
בנו של לזאר, סאדי קרנו, ניסח בהמשך לעבודתו של אביו את עקרון קרנו, המהווה בסיס לחוק השני של התרמודינמיקה. ניסוחים נוספים של החוק נטבעו באמצע המאה ה-19 על ידי רודולף קלאוזיוס ולורד קלווין. חוק זה הוא שהוביל בסופו של דבר להגדרה של מצב שיווי המשקל התרמודינמי המקובלת עד היום.
מאפייני שיווי משקל תרמודינמי

יציבות תרמודינמית

כמו במכניקה, גם בתרמודינמיקה ישנם מספר סוגי יציבות עבור שיווי משקל תרמודינמי, המוגדרים על פי תכונות הפוטנציאל.[4] הנגזרת השנייה של הפוטנציאל מתארת את שינוי המערכת בהתאם לשינוי המאפיינים התרמודינמיים שלה ולכן יציבות המערכת נקבעת על פיה:
- שיווי משקל יציב: המערכת חוזרת למצבה המקורי לאחר שינוי קטן בתנאים התרמודינמיים.
- שיווי משקל יציב למחצה (מטסטבילי): המערכת יציבה עבור שינויים קטנים מאוד, אך עבור שינויים מעט גדולים יותר אינה חוזרת לשיווי משקל.
- שיווי משקל נייטרלי (אדיש): המערכת תקבל את השינוי בתנאים התרמודינמיים ותתייצב במצב החדש.
- שיווי משקל לא יציב: שינויים אינפיניטסימליים מוציאים את המערכת מאיזון.
שיווי משקל מקומי וגלובלי
שיווי משקל תרמודינמי גלובלי מאופיין בכך שתנודות של המשתנים האינטנסיביים לא מוציאים את המערכת ממצב שיווי המשקל.[5]
לעומת זאת, שיווי משקל מקומי הוא אזור קטן במערכת הנמצא בשיווי משקל, כך שבאזור זה ניתן להתייחס למשתנים התרמודינמיים כהומוגניים. עבור אזור זה, נדרש כי יהיו מספיק מולקולות כך שחוקי התרמודינמיקה יחולו עליו. כלומר, מערכת תרמודינמית יכולה להיות מחוץ לשיווי משקל, ואזורים מסוימים בה יהיו בשיווי משקל מקומי. כנגזרת מהגדרה זו, שינוי קטן של מערכת בשיווי משקל מקומי יוביל ליציאה משיווי המשקל ובסופו של דבר הגעה למצב שיווי משקל אחר, שגם הוא מקומי. שיווי משקל תרמודינמי בטבע הוא כמעט תמיד שיווי משקל מקומי.
הפיכות תרמודינמית
תהליך אינפיניטסימלי הוא תהליך שכולל שינויים אינפיניטסימליים במאפיינים המאקרוסקופיים של המערכת. לפי מקס פלאנק, ישנם שלושה סוגים של תהליכים אינפיניטסימליים:[6]
תהליך טבעי יוגדר כתהליך המניע את המערכת לכיוון מצב שיווי המשקל התרמודינמי שלה, מפני שהמערכת שואפת להגיע למצב זה.
בהתאמה, תהליך לא טבעי יוגדר כתהליך שבו המערכת מתרחקת ממצב שיווי המשקל שלה.
תהליך הפיך הוא תהליך שקורה סביב מצב שיווי המשקל של המערכת. מערכת תרמודינמית שעוברת תהליך הפיך נמצאת לאורך כל התהליך בשיווי משקל תרמודינמי. כאשר המערכת בשיווי משקל, לא יכול לקרות כל סוג של תהליך שאינו הפיך.
שיווי משקל תרמודינמי מבחינה מיקרוסקופית
מצב שיווי המשקל התרמודינמי מתייחס למצב המאקרוסקופי של המערכת, והוא מוגדר בתור המצב המאקרוסקופי שמספר המצבים המיקרוסקופיים שמתאימים לו הוא הגבוה ביותר.
מבחינה מיקרוסקופית, מצב שיווי משקל תרמודינמי מאופיין במעבר מהיר ואחיד על כל המצבים המיקרוסקופיים המתאימים לתנאי השפה במערכת. אם המעבר בין מצבים אלו מהיר מספיק, בעת מדידה מאקרוסקופית, המערכת עוברת בין כל המצבים המיקרוסקופיים שלה בזמן אינפיניטסימלי.[2] מערכת המקיימת זאת נמצאת בשיווי משקל. אולם, אם המעבר בין המצבים אינו מהיר מספיק, מדידה של המערכת לא תייצג את המערכת כראוי מבחינה מיקרוסקופית.
מכאן נובעת ההנחה הארגודית. זוהי הנחה בסיסית בתרמודינמיקה, שלפיה כל המצבים המיקרוסקופיים הזמינים של מערכת סגורה הם שווי הסתברות. זאת משום שבמדידה אנחנו יכולים לקבל כל מצב מיקרוסקופי. מהנחה זו ניתן להסיק כי המצב שלו מתאימים מספר המצבים המיקרוסקופיים הרבים ביותר, כלומר מצב שיווי המשקל התרמודינמי, הוא המצב המסתבר ביותר במערכת.
הגדרת שיווי המשקל התרמודינמי באופן מתמטי

אנו מניחים שישנו מצב מאקרוסקופי שלו מתאימים מספר גדול בהרבה של מצבים מיקרוסקופיים ביחס למצבים המאקרוסקופיים האחרים. על כן, על פי ההנחה הארגודית, הוא מסתבר מאוד ביחס אליהם. על מנת לראות זאת מבחינה מתמטית נשתמש בפונקציית הריבוי g המתארת את מספר המצבים המיקרוסקופיים כתלות במצב מאקרוסקופי מסוים. המצב המאקרוסקופי המתואר בפונקציית הריבוי נקבע באופן כללי על ידי שני משתנים: N ו-S, כאשר N הוא מספר החלקיקים במערכת, ו-S משתנה כתלות במערכת. (למשל, במערכת ספינים הוא מייצג את ההפרש בין הספינים הפונים מעלה לאלו הפונים מטה.)
במערכת כללית, פונקציית הריבוי מחושבת באופן קומבינטורי באמצעות הנוסחה לתמורות.
במערכת שבה כל חלקיק יכול להיות בשני מצבים, פונקציית הריבוי נתונה על ידי:
כאשר הוא מספר החלקיקים במצב 1, ו- הוא מספר החלקיקים במצב 2.
תחת קירוב סטירלינג, פונקציית הריבוי מקבלת צורה של גאוסיאן:
כאשר הפרמטר S מוגדר כך: .
כאשר N גדול לפונקציית הריבוי g יש מקסימום חד מאוד במצב שיווי המשקל. על פי הגדרה, בגבול פונקציית הריבוי שואפת לפונקציית דלתא (פונקציה שלה מקסימום אינסופי בנקודה 0). נקודת המקסימום היא מצב שיווי המשקל של המערכת.
החוק השני של התרמודינמיקה ושיווי משקל
בתהליך ההיסטורי של ניסוח החוק השני של התרמודינמיקה הוגדר גודל אקסטנסיבי שנקרא אנטרופיה. לפי נוסחת האנטרופיה של בולצמן, האנטרופיה של מערכת תרמודינמית מוגדרת על ידי פונקציית הריבוי שלה:
לחוק השני של התרמודינמיקה קיימים מספר ניסוחים שקולים. הניסוח המקובל כיום נוגע לערך האנטרופיה במערכת סגורה: במערכת מבודדת, לא קיים תהליך תרמודינמי שכתוצאה ממנו האנטרופיה קְטֵנָה. במערכת כזו, האנטרופיה שואפת להגיע לערך מקסימלי.
נסמן ב- את האנרגיה הפנימית של המערכת, ב- את האנטרופיה של המערכת וב- את נפח המערכת. כאמור לעיל, שיווי משקל תרמודינמי של מערכת מוגדר על ידי נקודת המקסימום של פונקציית הריבוי. מהגדרת האנטרופיה ניתן להסיק כי נקודה זו היא גם נקודת המקסימום של האנטרופיה. מהחוק השני של התרמודינמיקה נובע באופן ישיר כי מערכת שואפת להגיע למצב שיווי המשקל התרמודינמי שלה. מכאן נוסח עקרון המקסימום של האנטרופיה:
במערכת אדיאבטית, שבה לא מתקיים מעבר חום בין המערכת לסביבה, האנטרופיה גדלה עד שהמערכת מגיעה לנקודת שיווי המשקל התרמודינמי שלה. ערכו בשיווי משקל של כל משתנה חופשי במערכת סגורה, כלומר מערכת עם , ו- נתונים וקבועים בזמן, הוא זה שיביא למקסימום של האנטרופיה.
ישנם עקרונות נוספים עבור גדלים תרמודינמיים שונים, השקולים לעקרון המקסימום של האנטרופיה. למשל, עקרון המינימום של האנרגיה הפנימית גורס כי בשיווי משקל ערכו של כל משנה חופשי במערכת סגורה בעלת אנטרופיה קבועה (כלומר מערכת עם , ו- נתונים וקבועים ובזמן) הוא זה שיביא למינימום של האנרגיה הפנימית.
עקרון המקסימום של האנטרופיה שקול לעקרון המינימום של האנרגיה הפנימית. על מנת לראות זאת, נסתכל על מערכת סגורה (אך לא מבודדת, כך שבין המערכת לסביבה ישנו חילוף אנרגיה) הנמצאת במצב שיווי משקל, ושעבור אנרגיה פנימית נתונה , האנטרופיה מקסימלית. נניח בשלילה שעבור ערך האנטרופיה, האנרגיה אינה מינימלית. כלומר, המערכת יכולה לבצע עבודה על הסביבה וכך תקטן האנרגיה הפנימית. כעת, נחזיר את האנרגיה הפנימית בצורת חום. על פי אי השוויון של קלאוזיוס, מתקיים כאשר מתאר את השינוי בחום של המערכת, והוא חיובי בתהליך זה. על כן, האנטרופיה גדלה בסתירה לכך שהמערכת בשיווי משקל ולכן האנטרופיה מקסימלית.[7] מכאן נובע שבמערכת סגורה שבה ערך האנטרופיה מקסימלי, האנרגיה הפנימית במינימום.
עקרונות אקסטרמום נוספים של שיווי משקל תרמודינמי
כמו עקרון המקסימום של האנטרופיה, קיימים עקרונות אקטסרמום נוספים. עקרונות אלו שקולים, אך מתייחסים לתהליכים שונים המתרחשים במערכת. עקרון האקסטרמום שבו נכון להתחשב עבור מערכת תרמודינמית מסוימת תלוי במשתנים התרמודינמיים הקבועים בתהליך אותו עוברת המערכת.
- מערכת מבודדת תרמית ואיזוברית: המערכת מבודדת מהסביבה ולכן , ואיזוברית כך שמתקיים . המשתנה שיהיה במקסימום במצב שיווי משקל הוא האנתלפיה:
- מערכת איזוכורית שאינה מבודדת מהסביבה: כעת, כדי שהמערכת תהיה במצב שיווי משקל, נדרוש , וכן המערכת איזוכורית ולכן . כלומר הפוטנציאל התרמודינמי שיקיים עקרון אקסטרמום הוא האנרגיה החופשית של הלמהולץ:
- מערכת איזוברית שאינה מבודדת מהסביבה: באופן דומה מתקיים וכן . האנרגיה החופשית של גיבס היא המשתנה התרמודינמי שיהיה במינימום במצב שיווי המשקל:
דו קיום - שיווי משקל תרמודינמי בין שתי פאזות
מעקרונות האקסטרמום אנו מבינים כי בשיווי משקל תרמודינמי, עבור הפוטנציאל המתאים הנגזרת הראשונה מתאפסת. כלומר, בשיווי משקל תרמודינמי, המשתנים האינטנסיביים אחידים בכל המערכת.
נסתכל על מערכת בעת מעבר פאזה. למערכת כזו ישנו קו דו קיום, שבו חלקיקים עוברים בין פאזה אחת לשנייה. נסמן את מספר החלקיקים בפאזה הראשונה ב- ואת מספר החלקיקים בפאזה השנייה ב-. מספר החלקיקים הכולל הוא קבוע, ולכן לאורך קו הדו קיום:
כמו כן, על פי עקרון המינימום של האנרגיה החופשית של גיבס, בשיווי משקל תרמודינמי אנרגיית גיבס צריכה להיות מינימלית, בין היתר על קו הדו קיום:
כלומר, במצב דו קיום בשיווי משקל . מתנאי זה מפותחת משוואת קלאוזיוס קלפרון, המתארת את קו הדו קיום במערכת סגורה.
שיווי משקל תרמי
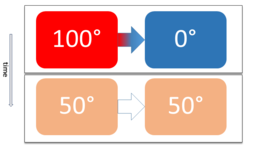
כאשר מערכת עוברת ממצב כללי למצב שיווי משקל תרמודינמי, מעבר של אנרגיה בין המערכת לסביבה אפשרית בצורת חום וכן בצורת עבודה.
אם נמקם שתי מערכות בצימוד תרמי, אנחנו למעשה מאפשרים מעבר אנרגיה בצורת חום בין שתי המערכות, ולא בצורת עבודה. באופן טבעי ובהתאם לחוק השני של התרמודינמיקה, חום יעבור בין שתי המערכות עד שיגיעו למצב שיווי המשקל המשותף. במצב זה שתי המערכות נמצאות בשיווי משקל תרמי.
כלומר, מעבר של המערכת המשותפת ממצב כללי למצב של שיווי משקל תרמי קורה באמצעות מעבר של אנרגיה בצורת חום בלבד כתוצאה מהצימוד התרמי.
מכאן נוכל להסיק כי אחד ההבדלים העיקריים בין שיווי משקל תרמודינמי לשיווי משקל תרמי הוא שהאחרון מתקבל כתוצאה ממעבר חום בלבד, בעוד שהראשון מתיר גם מעבר של עבודה.[4]
מכיוון שיש מעבר חופשי של חום בין המערכות, שיווי משקל תרמי מאופיין גם הוא במקסימום של האנטרופיה. כתוצאה מכך מתקיים:[8]
האנרגיה והנפח של המערכת המורכבת משני הגופים קבועים בתהליך, לכן: ובנוסף . נציב זאת:
ו- הם בלתי תלויים ולכן כל חלק במשוואה מתאפס בנפרד. לכן מתקיים:
בנוסף, אם נאפשר מעבר נפח בין המערכות (למשל בצורת בוכנה), ומתקיים:
סך הכל קבלנו שבין שתי המערכות מתקיים . כלומר, שתי מערכות בצימוד תרמי, שביניהן מעבר חופשי של חום ונפח, יגיעו לשיווי משקל תרמי כאשר הטמפרטורה והלחץ שלהן שווים.
הבדל נוסף נובע מהמאפיינים של שיווי המשקל התרמי. שתי מערכות מוגדרות בשיווי משקל תרמי כאשר אין מעבר חום ביניהן, או כאשר אין זרימת חום בין חלקיה השונים של מערכת (שיווי משקל תרמי פנימי). לעומת זאת, שיווי משקל תרמודינמי דורש בנוסף גם שיווי משקל מכני וכימי.
מערכות מחוץ לשיווי משקל
כאשר התנאים לשיווי משקל תרמודינמי לא מתקיימים, המערכת מוגדרת באי-שיווי משקל תרמודינמי. במצב אי-שיווי משקל, כאשר פועלים על המערכת כוחות שאינם מאוזנים, יכולות להתרחש תופעות כמו האצה, מערבולות, גלים ועוד. במצב זה, המאפיינים המאקרוסקופיים שלה, כמו טמפרטורה או לחץ, אינם הומוגניים בין חלקי המערכת.[5]
בנוסף, אנרגיה וחומר יכולים לעבור בין מערכת באי-שיווי משקל לסביבה.
כתוצאה מכך, כאשר מערכת נמצאת מחוץ לשיווי משקל לא ניתן לתאר אותה לפי המשתנים התרמודינמיים בהגדרתם הקלאסית, המתייחסים למערכת כשלמה. תנודות של משתנים אלו ישפיעו על המערכת וישנו את מצבה כאשר היא אינה בשיווי משקל. תנודות קטנות יכולות אף להתעצם ולגרום לחשל.
שיווי משקל תרמודינמי של כוכבים
שיווי משקל תרמודינמי הוא מושג מרכזי באסטרופיזיקה, העוזר לפשט מודלים קוסמולוגיים.
ביקום מתקיימות באופן רציף אינטראקציות בין פוטונים לחלקיקי חומר בגז. כאשר הפוטונים והחומר בשיווי משקל סטטיסטי זה עם זה נצפה כי הם יקיימו את חוק פלאנק ויתוארו על פי סטטיסטיקת מקסוול-בולצמן. במצב כזה, נניח כי הגז מקיים שיווי משקל תרמודינמי. כאשר תנאי זה לא מתקיים, נניח כי ישנו שיווי משקל תרמודינמי מקומי בגז.[9]
לעומת זאת, כאשר מדובר על כוכב כמערכת תרמודינמית, לא נוכל להניח שיווי משקל תרמודינמי גלובלי. סיבה אחת לכך היא שאנרגיה נפלטת מהכוכב, משמע הכוכב בהכרח לא נמצא בשיווי משקל תרמודינמי גלובלי. לכן, בביצוע מחקרים נהוג להניח שיווי משקל תרמודינמי מקומי.[10]
ראו גם
לקריאה נוספת
- Gibbs, J. Willard (Josiah Willard)., On the equilibrium of heterogenous substances, Connecticut Academy of Arts and Sciences, 1874-1878
- R. E. Samuelson, <0711:nlteic>2.0.co;2 Non-Local Thermodynamic Equilibrium in Cloudy Planetary Atmospheres, Journal of the Atmospheric Sciences 27, 1970 doi: 10.1175/1520-0469(1970)027<0711:nlteic>2.0.co;2
- E. Wigner, On the Quantum Correction For Thermodynamic Equilibrium, Physical Review 40, 1932 doi: 10.1103/physrev.40.749
- R. A. Akmaev, On the energetics of maximum-entropy temperature profiles, Quarterly Journal of the Royal Meteorological Society 134, 2008 doi: 10.1002/qj.209
- S. Prestipino, P. V. Giaquinta, The concavity of entropy and extremum principles in thermodynamics, Journal of Statistical Physics 111, 2003, עמ' 479–493 doi: 10.1023/A:1022233814184
קישורים חיצוניים
- שיווי משקל תרמודינמי, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
- ↑ Zemansky, Mark Waldo., 2, Heat and thermodynamics : an intermediate textbook, 7th Edition, McGraw Hill, 1997, עמ' 29, מסת"ב 0-07-114816-7
- ^ 2.0 2.1 Callen, H. B., 1, Thermodynamics an introduction to thermostatistics, 2nd Edition, John Wiley & Sons, 1985, עמ' 13-14, מסת"ב 0-471-86256-8
- ↑ Müller, Ingo, 1936-, 3-4, A history of thermodynamics : the doctrine of energy and entropy, Springer, 2007, עמ' 52-79, מסת"ב 1-280-96003-5
- ^ 4.0 4.1 C. J. Adkins, 1, Equilibrium Thermodynamics, 3rd Edition, Cambridge University Press, 1983-07-14, עמ' 6-8, מסת"ב 978-0-521-25445-8
- ^ 5.0 5.1 Yaşar Demirel, 3, Nonequilibrium Thermodynamics, 2nd Edition, Elsevier, 2007, עמ' 119-120, מסת"ב 978-0-444-53079-0
- ↑ Yaşar Demirel, 1, Nonequilibrium Thermodynamics, 2nd Edition, Elsevier, 2007, עמ' 2, מסת"ב 978-0-444-53079-0
- ↑ Nicholas W. Tschoegl, 4, Fundamentals of Equilibrium and Steady-State Thermodynamics, 1st Edition, Elsevier, 2000, עמ' 26, מסת"ב 978-0-444-50426-5
- ↑ Plischke, Michael., 1, Equilibrium statistical physics, 3rd Edition, World Scientific, 2005, עמ' 16, מסת"ב 981-02-5604-3
- ↑ Collins, George W. (George William), 1937-, 1, The fundamentals of stellar astrophysics, NASA Astrophysics Data System, 2003, עמ' 14
- ↑ Lecar, Myron, Departures from local thermodynamic equilibrium in an AO star atmosphere, National Aeronautics and Space Administration, 1964
שיווי משקל תרמודינמי31665094Q51363


