שיווי משקל כימי
שיווי משקל כימי או שיווי משקל דינמי (באנגלית: Chemical equilibrium) הוא השלב בתגובה הכימית שבו הרכב תערובת התגובה לא משתנה עוד. זהו מצב דינמי, כלומר, אין העדפה אנרגטית להתקדמות התגובה לכל כיוון ועל כן אין שינוי במצב המגיבים לאורך זמן.
המדע העומד בבסיס תורת שיווי המשקל הכימי הוא מאבני היסוד החשובים ביותר בתכנון של תגובות כימיות במעבדה ובתעשייה, וממוקדי העיסוק המרכזיים של מהנדסי כימיה וכימאים.
שיווי משקל הומוגני ושיווי משקל הטרוגני
בשיווי משקל הומוגני (homogeneous equilibrium) - כל המגיבים וכל התוצרים נמצאים בפאזה אחת. לדוגמה, ניתן לציין את התגובה:
בה כל החומרים המעורבים נמצאים בצורה גזית. לעומת זאת התגובה:
בה חומצה הידרוברומית מהולה מגיבה עם תמיסת אשלגן חנקתי, לקבלת תמיסה מימית של אשלגן ברומי וחומצה חנקתית. מהווה דוגמה לשיווי משקל הומוגני בפאזה הנוזלית.
בשיווי משקל הטרוגני (heterogeneous equilibrium) - המגיבים והתוצרים נמצאים ביותר מפאזה אחת. לדוגמה, התגובה בין שבבי אבץ מתכתי עם קיטור (אדי מים) ליצירת אבץ חמצני (מוצק) ומימן גזי, כולל שתי פאזות, מוצק וגז:
באופן כללי, תגובות כימיות יגיעו לשיווי משקל מהיר יותר בפאזה הגזית או הנוזלית, שכן במצבי צבירה אלו אין מגבלה משמעותית על הקינטיקה של התגובה.
צורת הרישום המוסכמת
עבור התגובה הכללית בין המגיבים A ו-B לקבלת התוצרים C ו-D:
אם התגובה נמצאת בשיווי משקל, אזי נשתמש בחץ כפול, המצביע על כך ששתי התגובות (הקדמית - ליצירת התוצרים, וההפוכה - ליצירת המגיבים) מתרחשות בקצב זהה.
האותיות a,b,c,d הם המקדמים הסטוכיומטרים של התגובה.
קבוע שיווי המשקל
קבוע שיווי המשקל הוא ערך מספרי המבטא את יחס מכפלת ריכוזי התוצרים במכפלת ריכוזי המגיבים בשיווי משקל. קבוע שיווי המשקל מבטא את הרכב המערכת הכימית במצב זה.
עבור התגובה הכללית בין המגיבים A ו-B לקבלת התוצרים C ו-D, הנמצאת בשיווי משקל:
ישנן 2 הגדרות שימושיות לקבוע שיווי משקל (המסומן באות K), המובאות בטבלה הבאה:
| קבועי שיווי משקל | ||
| שם | הביטוי | תיאור |
| קבוע ריכוזים | יחס מכפלת ריכוזי התוצרים במכפלת ריכוזי המגיבים בשיווי משקל | |
| קבוע לחצים | יחס מכפלת הלחצים החלקיים של התוצרים במכפלת הלחצים החלקיים של המגיבים בשיווי משקל (משמש כשהמערכת הכימית מכילה בעיקר גזים) | |
| הערה: כל ערך מועלה בחזקה של המקדם הסטוכיומטרי שלו | ||
| הקשרים המתמטיים בין ל- הם:
כש- הוא הפרש סכומי המקדמים הסטוכיומטרים של התוצרים מסכומי המגיבים: , הוא קבוע הגזים, ו- היא הטמפרטורה במעלות קלווין. | ||
דגשים:
- ערכו של קבוע שיווי המשקל משתנה מתגובה לתגובה, והוא תלוי בטמפרטורה.
- קבוע שיווי המשקל אינו מלמד על מהירות התגובה אלא רק על הרכב המערכת בשיווי משקל.
- חומרים שהם נוזלים או מוצקים טהורים, אינם נכנסים לחישוב ערכי קבוע שיווי המשקל.
_________________________________________________________
לדוגמה, עבור התגובה לייצור האמוניה (תהליך הבר-בוש):
קבוע שיווי המשקל יבוטא באופן הבא:
_________________________________________________________
לדוגמה, עבור התגובה להכנת סידן חמצני (סיד חי) מסידן פחמתי:
קבוע שיווי המשקל יבוטא באופן הבא:
*אין מחשיבים את ואת כי הם מוצקים טהורים.
| מניפולציות על קבועי שיווי המשקל | ||
| המשוואה | הביטוי לקבוע שיווי המשקל | הסבר |
| הגדרה כללית | ||
| הפיכת התגובה, מביאה להפיכת קבוע שיווי המשקל | ||
| הכפלת התגובה במקדם מולרי (n) מביאה להעלאת הקבוע בחזקה המתאימה למקדם | ||
| הערה: בחיבור של תגובות כימיות, ניתן להכפיל את קבועי שיווי המשקל אלו באלו כדי לקבל את קבוע שיווי המשקל לתגובה הכוללת. | ||
משמעות ערכו של קבוע שיווי המשקל
ערך גבוה של K מציין כי, המונה גדול יחסית למכנה בביטוי של K. פירוש הדבר כי, בשיווי משקל ריכוזי התוצרים גדולים בהשוואה לאלה של המגיבים, ולכן התגובה ההפיכה הנ"ל נוטה יותר לכיוון ימינה, כלומר - לכיוון יצירת התוצרים (C ו-D) על חשבון המגיבים (A ו-B). מצד שני, כאשר K קטן, הדבר מורה על יחס קטן בין התוצרים למגיבים, שמשמעותו - יותר מגיבים על חשבון התוצרים.
חישוב ערכו של קבוע שיווי המשקל בטמפרטורה שונה
ניתן לחשב את ערך קבוע שיווי המשקל, של תגובה המתרחשת בתהליך איזוכורי (נפח קבוע) עבור כל טמפרטורה, על פי משוואת ואן 'ט הוף:
כש- הוא שינוי האנתלפיה התקני בתגובה ו- הוא קבוע הגזים.
הקשר בין האנרגיה החופשית לקבוע שיווי המשקל
הקשר בין האנרגיה החופשית של התגובה () להרכב תערובת התגובה בכל שלב של התגובה, נתון על ידי המשוואה הבאה:
כש-Q הוא מנת התגובה: אלא שהוא לא מבטא בהכרח מצב של שיווי משקל, אלא רק מבטא את הרכב המערכת בנקודה מסוימת בזמן.
מכאן שבמידה וידוע שהמערכת נמצאת בשיווי משקל אזי: , ומכאן:
ולכן:
עיקרון לה שטלייה והתנהגות מערכת כימית כתוצאה מיציאה משיווי משקל

האופן בו מערכת כימית מתנהגת בתגובה ליציאה משיווי משקל נוסח על ידי הכימאי הצרפתי אנרי לה שטלייה, ומכונה על שמו: עקרון לה שטלייה.
הגדרה רשמית:
"כאשר מפעילים עקה (סטרס) על מערכת המצויה בשיווי משקל דינמי, שיווי המשקל נוטה להשתנות בדרך הממזערת את השפעת העקה"
כלומר, המערכת תשאף למזער את השפעתן של עקות המופעלות עליה על ידי ביצוע שינויים פנימיים שמטרתן לחזור לשיווי משקל.
| עקות שכיחות והשפעתן על שיווי המשקל | |
| העקה | השפעות |
| שינוי טמפרטורה | העלאת הטמפרטורה של תגובה אקסותרמית תביא להעדפה התגובה ההופכית (האנדותרמית) שתביא לייצור המגיבים, ולהפך. |
| תביא לשינוי קבוע שיווי המשקל. | |
| שינוי לחץ / נפח | דחיסה של תערובת תגובה בשיווי משקל מניעה את התגובה בכיוון המקטין את מספר המולקולות בפאזה הגזית (הערה: להעלאת הלחץ על ידי הוספת גז אדיש אין השפעה על הרכב השיווי משקל). |
| הוספת זרז | לא תשפיע על הרכב השיווי משקל, אלא רק תאיץ את קצב ההגעה לשיווי המשקל. |
| דוגמה לעקרון לה שטלייה | |

|
התגובה: |
| אחת הדוגמאות המפורסמות שמשמשות להדגמת העקרונות של שיווי משקל כימי היא זו של יצרת מ-. זוהי תגובה אנדותרמית, כלומר, תגובה שדורשת חום.
בתמונה מימין, 2 בקבוקים המכילים תערובת של שני הגזים הללו, הנמצאים בטמפרטורות שונות. כשחום הוזרם אל הבקבוק הימני, שיווי המשקל הוסט לכיוון יצירת (התהליך האנדותרמי) לקבלת תערובת גזים חומה-צהבהבה עם ריכוז גבוה יחסי של . לעומת זאת, הבקבוק השמאלי (בעל הצבע החום-אדמדם), שהונח בקירור, הרכב הגזים בו נטה לכיוון התגובה ההפוכה, והאקסותרמית לקבלת המגיב - . | |
חשיבות תעשייתית
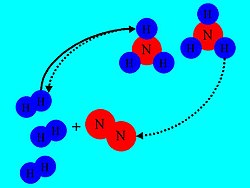
מרבית התגובות הכימיות אינן הולכות עד תום, ובדרך כלל, מסתיימות בהגעה אל שיווי משקל בו המערכת מכילה הן תוצרים והן מגיבים, אולם, בתעשייה יש צורך בתכנון תגובות עם ניצולת גבוהה, כלומר אחוז המרה גבוה של תוצרים ביחס למגיבים. על כן, החשיבות של תכנון תהליכים ותגובות להן העדפה לתגובה "קדימה" היא קריטית.
הידע הנצבר בתחום שיווי המשקל הכימי הודות לאנרי לה שטלייה והעיקרון שניסח (בנוסף לתרומתם של כימאים נוספים) משמשים כבסיס המדעי בתכנון ופיתוח של תגובות כימיות.
נתבונן לדוגמה בתגובה לייצור אמוניה (תהליך הבר-בוש), ובאופן בו מיושמים עקרונות השיווי המשקל הכימי להגדלת אחוז ההמרה לקבלת אמוניה מחומרי הגלם מימן וחנקן:
- לחץ - הגברת הלחץ במכל התגובה תביא ליצירת אמוניה - מכיוון שעל ידי כך המערכת תצליח להקטין את העקה (הלחץ): מארבעה מולים של מימן וחנקן נוצרים שני מולים של אמוניה.
- טמפרטורה - התגובה ליצירת האמוניה היא אקסותרמית (כלומר, פולטת חום) ולכן, קירור מכל התגובה יגרום להעדפת התוצרים - כלומר, יצירה של אמוניה. אולם, יש לשים לב, שקירור יתר, יעלה את משך הזמן להתהוות אמוניה, וזאת מכיוון שקירור מאט את מספר ההתנגשויות ולכן את הסיכוי להתהוות תוצרים. לכן בתעשייה מתחשבים בבעיה זאת ומשלבים חום גבוה יחסית עם לחץ גבוה וכדומה.
- שינוי בריכוז החומרים - לאחר שהמערכת הגיעה לשיווי משקל ניתן להוציא את האמוניה מהמכל. ניתן לעשות זאת על ידי קירור, תוך ניצול הבדלים בנקודת הרתיחה של החומרים המשתתפים בתהליך. האמוניה תהיה נוזלית בעוד שהמימן והחנקן יישארו גזים. כעת לפי עקרון לה-שטליה המערכת תשאף להגדיל את ריכוז התוצר מאחר שהפחתנו אותו. משמע: תיווצר לנו עוד אמוניה.
לקריאה נוספת
- פיטר אטקינס ולורטה ג'ונס, כימיה כללית: כרך א', פרק 9 - שיווי משקל כימי, האוניברסיטה הפתוחה, 2010
קישורים חיצוניים
- ארז גרטי, שיווי משקל כימי, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 28 ביוני 2011
- שיווי משקל כימי, באתר אנציקלופדיה בריטניקה (באנגלית)
| תגובות כימיות | |||||
|---|---|---|---|---|---|
| מיון תגובות | |||||
| על-פי מנגנון | |||||
| על-פי תרמודינמיקה |
| ||||
| מונחים | |||||
| קינטיקה של תגובות כימיות | תאוריית ההתנגשויות המולקולריות • אנרגיה חופשית • קבוע קצב • משוואת קצב • שלב קובע המהירות • אנרגיית שפעול • מצב מעבר • חומר ביניים • שיווי משקל כימי • טמפרטורה • לחץ • זרז | ||||
| נושאים נוספים | סטריאוכימיה • סטריאוסלקטיביות • סטריאוספציפיות • כיראליות • אפקט סטרי • היברידיזציה • קונפיגורציה מולקולרית • רזוננס כימי • היפרקוניוגציה • מערכת מצומדת • ארומטיות • כלל הופמן • כלל זייצב • כלל מרקובניקוב • כללי וודוורד-הופמן | ||||
| פורטל כימיה | |||||
שיווי משקל כימי32653812Q189520



