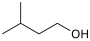
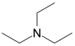
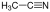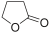ממס




מֵמֵס (בריבוי: מְמִסִּים; באנגלית: solvent, סולבנט) הוא חומר שיש ביכולתו להמס חומר אחר (המומס). רוב הממסים הם נוזלים, אך אין ההגדרה מחייבת שהממס יהיה במצב צבירה נוזלי.
הממס והמומס יוצרים יחד תמיסה בתהליך ההמסה (solvation).
רוב הממסים הקיימים הם תרכובות אורגניות, כלומר תרכובות המכילות אטומי פחמן. אף על פי כן, ישנם ממסים אחרים שאינם שייכים לקטגוריה זו כגון: מים, אמוניה ואף כספית (שהיא מתכת נוזלית בטמפרטורת החדר המסוגלת להמיס לתוכה מתכות שונות וליצור אמלגם).
ממסים עשויים לשמש ליישומים ישירים כגון חיטוי או כמקור אנרגיה (בצורה של דלק), או לשימושים עקיפים, כגון דילול (של חומרי צבע), המסה (של חומרי ריח, מזון ותרופות) או תיווך (בסינתזות כימיות, כמחליפי חום וכאלקטרוליטיים בתאים חשמליים).
מיון של ממסים

ניתן למיין ממסים על בסיס תכונות כימיות ופיזיקליות שונות. שלוש השיטות הנפוצות ביותר הן:
ההרכב הכימי של הממס
- ממסים מולקולריים (molecular liquids) – ממסים המורכבים ממולקולות נייטרליות שהאטומים שלהן מחוברים בקשרים קוולנטים (כגון ממסים אורגנים).
- ממסים יונים (ionic liquids) – מורכבים מצורנים טעונים חשמלית (קטיון ואניון).
- ממסים אטומים (atomic liquids) – המבוססים על היסודות של הטבלה המחזורית (כגון כספית).
היכולת לתרום יון מימן חיובי, הידרוניום (H+)
- ממסים פרוטים (protic Solvents) – ממסים אלה מכילים אטומי מימן "חומציים" שעשויים להיקטף על ידי מולקולות אחרות בקלות. בדרך כלל, תרכובות השייכות לקבוצה זו מכילות אטום מימן שמחובר לאחד מהאטומים הבאים: חמצן, חנקן, זרחן, גופרית, סלניום, פלואור, כלור, ברום, יוד. דוגמה לממסים השייכים לקבוצה זו הם: מים, כהלים, תיולים, אמינים וחומצות קרבוקסיליות.
- ממסים לא-פרוטים או אפרוטיים (aprotic solvents) – ממסים שאינם מכילי אטומי מימן, או שאטומי המימן בהן אינם נחשבים ל"חומציים". דוגמה למשפחות ממסים השייכות לקבוצה זו: אלקאנים, אלקנים, אלקינים, קטונים, אלדהידים ואסטרים. הממסים הלא-פרוטים משמשים ביישומים בהן נדרשת אדישות כימית גבוהה יותר של הממס, כגון בתאים אלקטרוכימיים הכוללים אנודות המבוססות על מתכות אלקליות פעילות, כגון ליתיום, נתרן, אשלגן. הממסים הלא-פרוטים מסוגלים להיות יציבים יחסית בנוכחות מתכות אלה. לו ייעשה שימוש בממס פרוטי, אזי תתרחש תגובה בה ייפלט גז מימן שאינו רצוי שייפלט בתוך סוללה. לדוגמה, אתנול (ממס פרוטי), בנוכחות נתרן (מתכת אלקלית פעילה) תביא ליצירת נתרן אתוקסיד (sodium ethoxide) ולפליטת גז מימן מהמערכת, על פי המשוואה הבאה:
מידת הקוטביות (פולאריות, polarity)
מידת הקוטביות ניתנת להערכה על ידי המקדם הדיאלקטרי של החומר, שמוגדר כיכולת של חומר לצמצם את השדה החשמלי שמפעיל חלקיק טעון המצוי בו.
- ממסים קוטביים (פולאריים) - לרוב עם ערכי דיאלקטריות גבוהים מ-15. לדוגמה, מים, אתנול, אצטון.
- ממסים לא קוטביים (לא פולאריים) - לרוב עם ערכי דיאלקטריות נמוכים מ-15. לדוגמה, בנזן, טולואן, הקסאן, כלורופורם.
תכונות פיסקליות חשובות של ממסים
- צפיפות – היא מסת החומר ליחידת נפח. נמדד לרוב ביחידות של גרם לסמ"ק (g/cm³) או (kg/m³).
- טמפרטורת היתוך - היא הטמפרטורה שבה נוזל שמתקרר מתגבש למוצק, ולחלופין מוצק שמתחמם ניתך לנוזל (מעלות צלזיוס או קלווין)
- טמפרטורת רתיחה - היא הטמפרטורה שבה לחץ אדים של חומר נוזלי משתווה ללחץ האטמוספירי שמופעל עליו, ובכך הופך החומר מנוזל לגז (מעלות צלזיוס או קלווין).
- נקודת הבזק - היא הטמפרטורה הנמוכה ביותר שבה נוזל הופך לאדים, ויוצר תערובת דליקה עם האוויר (מעלות צלזיוס או קלווין).
- נקודת התלקחות (נקודת ההצתה העצמית) - היא הטמפרטורה הנמוכה ביותר שבה חומר מתלקח מעצמו, וללא הפעלה של מקור הצתה חיצוני (מעלות צלזיוס או קלווין).
- צמיגות - מתארת את התנגדותו הפנימית של הזורם לזרימה [N·s/m² או kg/m·s]
- לחץ אדים (נדיפות) – מבטא את נטייתו של חומר כלשהו להתאדות (Pa).
- מקדם דיאלקטרי (פֶּרְמִיטִיבִיות) - היכולת של חומר לצמצם את השדה החשמלי שמפעיל חלקיק טעון המצוי בו.
- קיבול חום סגולי - מוגדר ככמות החום הנדרשת על מנת להעלות את הטמפרטורה של גוף נתון במעלת אחת (J/(mol⋅K) או (J/(Kg⋅K)
- מקדם שבירה - מציין את היחס שבין מהירות האור בריק למהירות האור בממס (ככל שמקדם השבירה גדול יותר, כך אור נע דרכו במהירות איטית יותר).
משפחת הממסים ההטרוציקלים
קבוצת ממסים חשובה ביותר, השייכת למשפחת הממסים האורגנים, היא קבוצת הממסים ההטרוציקלים. לקבוצה זו שייכים תרכובות אורגניות טבעתיות או רב טבעתיות שלהן תכונות מועדפות להמסת קטיונים מתכתיים על ידי יצירת קומפלקסים יציבים מאוד אתם. למשפחה זו שייכות תרכובות האתר כתר (crown ether), והקריפטנידים (cryptand).
על התגלית אודות קבוצת הממסים הזו, ועל פיתוח השיטות הסינתטיות לייצורן, הוענק בשנת 1987 פרס נובל לכימיה לצ'ארלס פדרסן, ז'ן-מארי להן ודונלד ג'יימס קראם.

ממסים באנליזות NMR (תהודה מגנטית גרעינית)


לממסים יש חשיבות גבוהה באנליזות כימיות רבות, בדגש על אנליזת תהודה מגנטית גרעינית (NMR - nuclear magnetic resonance) המשמשת לקביעת המבנה הכימי של מולקולות.
החומר שעבורו יש לבצע את אנליזת ה-NMR עובר המסה בממס אורגני מתאים, ומוכנס אל מכשיר ה-NMR, שם נבחנים התנאים המגנטיים בחומר על בסיס הקרינה הנפלטת מגרעין האטום, כתלות בין תגובת גרעין האטום המצוי בשדה מגנטי חיצוני קבוע, לבין שדה אלקטרומגנטי המשתנה בתדירות המתאימה לתדר התהודה של החומר הנבדק.
באנליזת NMR של פרוטונים (HNMR - proton nuclear magnetic resonance) לא ניתן להשתמש בממסים אורגנים המכילים אטומי מימן (H), כיוון שכך לא יתאפשר להבדיל בין תוצאות האנליזה שהתקבלו מהחומר הנבדק (המומס) לזה של הממס. על כן, נעשה שימוש בממסים שעברו דיוטוריזציה (deuteration) כלומר, שכל אטומי המימן (H) בהן הוחלפו לאטומי דאוטריום (D; איזוטופ מימן שבגרעינו יש נייטרון).[1]
תהליך הייצור הכימי של ממסים המכילים אטומי דאוטריום הוא יקר, בעיקר מכיוון שחומר הגלם העיקרי לייצורן הוא מים כבדים. לשם השוואה, מחירו של קילוגרם מים כבדים הוא כ-60 דולר, לעומתו, שוויו של קילוגרם כלורופרום (עם אטומי דאוטריום) הוא כ-1000 דולרים[2]
מבנה של כמה ממסים חשובים באנליזת HNMR. הממסים הללו מכילים את איזוטופ הדאוטריום במקום אטומי המימן.
|
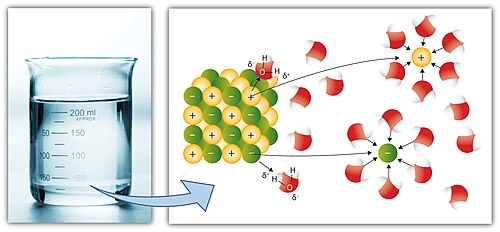
מים "כממס האוניברסלי"
 ערך מורחב – מים
ערך מורחב – מים
המים הם ממס מוצלח מאוד למגוון רחב של שימושים. מולקולות המים הן מהתרכובות הנפוצות ביותר בכדור הארץ, הן נמצאות במצב צבירה נוזלי בטווח טמפרטורות רחב (0–100 °C), הן אינן רעילות או מסוכנות לסביבה ויש ביכולתן להמיס מגוון עצום של חומרים, בדגש על חומרים יונים, כגון מלח בישול. יכולת ההמסה של המים נובעת מערכי הדיפול הגבוהים במולקולה, המתקיימים הודות להפרשי האלקטרושליליות הגבוהים בין אטום החמצן לשני אטומי המימן הקשורים אליו. תכונות אלו, הקנו למים את התואר הלא-רשמי "ממס אוניברסלי" (universal solvent), אף-על פי שהמים אינם ממס אוניברסלי מוחלט, כיוון שהם אינם מסוגלים להמיס את כל התרכובות הקיימות, דוגמה פשוטה לכך היא חוסר המסיסות של שמן במים. השמן צף מעל פני המים ויוצר שכבה נפרדת ממנה.
ייבוש של ממסים אורגנים

לעיתים קרובות יש צורך לייבש ממס אורגני משאריות של ממסים אחרים שנמצאים בו (drying of organic solvents). כשהממס שאותו מבקשים לייבש הוא פרוטי, אזי מטרת הייבוש היא להרחיק מים, וכשהממס אותו מבקשים לייבש הוא אפרוטי, אזי מטרת הייבוש היא להרחיק כל ממס פרוטי שנמצא בו לרבות מים.
עבור שני סוגי הממסים, נהוג לבצע ייבוש לאחר פעולות מיצוי כימי, ובמקרה שמדובר בממס אפרוטי, מבצעים גם ייבוש לפני ביצוע תגובות הרגישות לנוכחות ממסים פרוטים (כגון תגובות גריניאר).

פעולות ייבוש נפוצות מאוד גם בתהליכי ההכשרה של ממסים אפרוטיים לשימוש כאלקטרוליטיים בתאים אלקטרוכימיים.
אופן פעולת הייבוש
פעולת הייבוש של ממס מתבצעת על ידי הוספה של ראגנט ייבוש לתוכו ולאחר מכן מבצעים סינון או זיקוק לקבלת הממס היבש.
ראגנטי ספיחה - מטרתן לספוח שאריות של מים מהממס האורגני. דוגמאות: סיבים מולקולריים (סיליקה ג'ל), מלחים היגרוסקופים (מגנזיום גופרתי, סידן גופרתי, סידן כלורי, אשלגן פחמתי).
ראגנטי נטרול כימי - מטרתן לנטרל ממסים פרוטים על ידי תגובה כימית אתם שמסתיימת לרוב בפליטת גז מימן. דוגמאות: ליתיום אלומיניום הידריד (LiAlH4), מתכות אלקליות (ליתיום, נתרן, אשלגן).
ממסים שימושיים בתעשייה הכימית
בטבלה הבאה מובאים נתונים עבור ממסים שימושיים בתעשייה הכימית. הערה: ניתן לבצע מיון של הערכים על ידי לחיצה על העמודה המבוקשת.
| שם הממס | מבנה החומר | טמפ' התכה [°C] |
טמפ' רתיחה [°C] |
נק' הבזק [°C] |
צפיפות [g/cm3] ב־20 °C |
מקדם דיאלקטרי ב־25 °C |
מומנט דיפול [· 10−30 Cm] |
מקדם שבירה |
פרוטי/לא פרוטי |
|---|---|---|---|---|---|---|---|---|---|
| אצטון | -95.35 | 56.2 | -19 | 0.7889 | 20.70 | 9.54 | 1.3588 | לא פרוטי | |
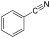
| אצטוניטריל | -45.7 | 81.6 | 13 | 0.7857 | 37.5 (20 °C) | 11.48 | 1.3442 | לא פרוטי | |
| אנילין | -6.3 | 184 | – | 1.0217 | 6.89 (20 °C) | 5.04 | 1.5863 | פרוטי | |
| אניסול | -37.5 | 155.4 | – | 0.9961 | 4.33 | 4.17 | 1.5179 | לא פרוטי | |
| בנזן | 5.5 | 80.1 | -8 | 0.87565 | 2.28 | 0.0 | 1.5011 | לא פרוטי | |
| בנזוניטריל | -13 | 190.7 | – | 1.0102 (15 °C) | 25.20 | 13.51 | 1.5289 | לא פרוטי | |
| ברומובנזן | -30.8 | 156 | – | 1.4950 | 5.40 | 5.17 | 1.5597 | לא פרוטי | |
| n-Butanol (בוטנול) | -89.8 | 117.3 | 34 | 0.8098 | 17.51 | 5.84 | 1.3993 | פרוטי | |
| מתיל טרט בוטיל אתר | -108.6 | 55.3 | -28 | 0.74 | ? | ? | 1.3690 | לא פרוטי | |
| gamma-Butyrolactone | -44 | 204–206 | 101 | 1.13 | 39.1 | 4.12 | 1.436 | לא פרוטי | |
| Quinoline | -15.6 | 238 | – | 1.0929 | 9.00 | 7.27 | 1.6268 | לא פרוטי | |
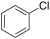
| כלורובנזן | -45.6 | 132 | 28 | 1.1058 | 5.62 | 5.14 | 1.5241 | לא פרוטי | |
| כלורופורם | -63.5 | 61.7 | – | 1.4832 | 4.81 (20 °C) | 3.84 | 1.4459 | לא פרוטי | |
| ציקלוהקסאן | 6.5 | 80.7 | 4.5 | 0.7785 | 2.02 (20 °C) | 0.0 | 1.4266 | לא פרוטי | |
| דיאתילן גליקול | -6.5 | 244.3 | 124 | 1.1197 (15 °C) | 7.71 | 7.71 | 1.4475 | פרוטי | |
| דיאתיל אתר | -116.2 | 34.5 | -40 | 0.7138 | 4.34 (20 °C) | 4.34 | 1.3526 | לא פרוטי | |
| דימתיל אצטאמיד | -20 | 165 | – | 0.9366 (25 °C) | 37.78 | 12.41 | 1.4380 | לא פרוטי | |
| דימתיל פורמאמיד | -60.5 | 153 | 67 | 0.9487 | 37.0 | 12.88 | 1.4305 | לא פרוטי | |
| דימתיל סולפוקסיד | 18.4 | 189 | – | 1.1014 | 46.68 | 13.00 | 1.4770 | לא פרוטי | |
| 1,4-Dioxane (דיאוקסין) | 11.8 | 101 | 12 | 1.0337 | 2.21 | 1.5 | 1.4224 | לא פרוטי | |
| חומצה אצטית | 16.6 | 117.9 | 42 | 1.0492 | 6.15 (20 °C) | 5.60 | 1.3716 | פרוטי | |
| אנהידריד אצטי | -73.1 | 139.5 | – | 1.0820 | 20.7 (19 °C) | 9.41 | 1.3900 | לא פרוטי | |
| אתיל אצטט | -83.6 | 77.06 | -2 | 0.9003 | 6.02 | 6.27 | 1.3723 | לא פרוטי | |
| אתנול | -114.5 | 78.3 | 18 | 0.7893 | 24.55 | 5.77 | 1.3614 | פרוטי | |
| 1,2-Dichloroethane (דוכלורואתאן) | -35.3 | 83.5 | – | 1.2351 | 10.36 | 6.2 | 1.4448 | לא פרוטי | |
| אתילן גליקול | -13 | 197 | 117 | 1.1088 | 37.7 | 7.61 | 1.4313 | פרוטי | |
| דימתוקסיאתאן | -58 | 84 | – | 0.8628 | 7.20 | 5.70 | 1.3796 | לא פרוטי | |
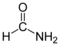
| פורמאמיד | 2.5 | 210.5 | – | 1.1334 | 111.0 (20 °C) | 11.24 | 1.4472 | פרוטי | |
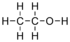
| הקסאן | -95 | 68 | -20 | 0.6603 | 1.88 | 0.0 | 1.3748 | לא פרוטי | |
| הפטאן | -91 | 98 | -4 | 0.684 | 1.97 | 0.0 | 1.387 | לא פרוטי | |
| איזופרופנול | -89.5 | 82.3 | 16 | 0.7855 | 19.92 | 5.54 | 1.3776 | פרוטי | |
| מתנול |  |
-97.8 | 64.7 | 6.5 | 0.7914 | 32.70 | 5.67 | 1.3287 | פרוטי |
| איזופנטיל אלכוהול | -117.2 | 130.5 | – | 0.8092 | 14.7 | 6.07 | 1.4053 | פרוטי | |
| טרטבוטנול |  |
25.5 | 82.5 | 9 | 0.7887 | 12.47 | 5.54 | 1.3878 | פרוטי |
| דיכלורומתאן |  |
-95.1 | 40 | – | 1.3266 | 8.93 | 5.17 | 1.4242 | לא פרוטי |
| בוטנון | -86.3 | 79.6 | – | 0.8054 | 18.51 (20 °C) | 9.21 | 1.3788 | לא פרוטי | |
| N-Methyl-2-pyrrolidone |  |
-24 | 202 | 245 | 1.03 | 32.2 | 4.09 | 1.47 | לא פרוטי |
| N-Methylformamide | -3.8 | 183 | – | 1.011 (19 °C) | 182.4 | 12.88 | 1.4319 | פרוטי | |
| ניטרובנזן | 5.76 | 210.8 | 81 | 1.2037 | 34.82 | 13.44 | 1.5562 | לא פרוטי | |
| ניטרומתאן | 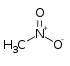 |
-28.5 | 100.8 | 35 | 1.1371 | 35.87 (30 °C) | 11.88 | 1.3817 | לא פרוטי |
| פנטאן | -130 | 36 | -49 | 0.6262 | – | – | 1.358 | לא פרוטי | |
| פיפרידין | -9 | 106 | – | 0.8606 | 5.8 (20 °C) | 3.97 | 1.4530 | פרוטי | |
| 1Propanol (פרופנול) | -126.1 | 97.2 | 24 | 0.8035 | 20.33 | 5.54 | 1.3850 | פרוטי | |
| פירידין |  |
-42 | 115.5 | 23 | 0.9819 | 12.4 (21 °C) | 7.91 | 1.5095 | לא פרוטי |
| פחמן דיסולפיד | -110.8 | 46.3 | -30 | 1.2632 | 2.64 (20 °C) | 0.0 | 1.6319 | לא פרוטי | |
| סולפולן | 27 | 285 | – | – | 43.3 (30 °C) | 16.05 | 1.4840 | לא פרוטי | |
| טטרה כלורו אתילן | 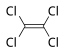 |
-19 | 121 | – | 1.6227 | 2.30 | 0.0 | 1.5053 | לא פרוטי |
| Carbon tetrachloride (טטרה כלורומתאן) |  |
-23 | 76.5 | – | 1.5940 | 2.24 (20 °C) | 0.0 | 1.4601 | לא פרוטי |
| טטרה הידרו פוראן |  |
-108.5 | 66 | -22.5 | 0.8892 | 7.58 | 5.84 | 1.4070 | לא פרוטי |
| טולואן |  |
-95 | 110.6 | 7 | 0.8669 | 2.38 | 1.43 | 1.4961 | לא פרוטי |
| 1,1,1-Trichloroethane |  |
-30.4 | 74.1 | – | 1.3390 | 7.53 (20 °C) | 5.24 | 1.4379 | לא פרוטי |
| טרי אתיל אמין | -114.7 | 89.3 | – | 0.7275 | 2.42 | 2.90 | 1.4010 | לא פרוטי | |
| מים | 0.0 | 100 | – | 0.9982 | 78.39 | 6.07 | 1.3330 | פרוטי |
בטיחות, בריאות וסביבה
 ערך מורחב – שאיפת ממסים נדיפים
ערך מורחב – שאיפת ממסים נדיפים

מרבית הממסים האורגנים נדיפים ודליקים מאוד. חלקם עשויים להתפוצץ (כגון פראוקסידים ותרכובות ניטרו), ועל כן יש להקפיד על כללי בטיחות מתאימים בעת אחסון ושינוע של הממסים הללו.

בנוסף, חלק גדול מאוד מהממסים האורגנים רעילים לאדם וחלקם חשודים כמסרטנים. לחלק מהממסים תכונות מרדימות, ועל כן, שימשו בעבר כחומרי הרדמה (כגון כלורופורם, דיאתיל אתר). יש ממסים, כגון אתנול, שנחשבים כסמים פסיכואקטיבים, ואחרים בעלי השפעה שעשויה להיות קטלניות, כגון מימן ציאנידי.
בשונה מממסים אורגנים, הנדיפים ודליקים ברובם, ממסים יונים, מפגינים יתרונות גדולים מאוד של חוסר נדיפות ודליקות עד לטמפרטורות של מאות מעלות צלזיוס. על כן, השימוש בהן הולך וגובר, אם כי, לא תמיד הם יכולים לספק את מכלול התכונות של ממס אורגני נתון.
גורם חשוב נוסף, שיש להביא בחשבון בעת שימוש בממסים הוא הסיכון העלול להתרחש בעת אירוע דליפה של הממס לסביבה, בהיבט של זיהום שטחי קרקע ומים.
בחירה הממס לשימוש בתגובות כימיות, הוא תחום חשוב של הכימיה הירוקה.
ראו גם
- תמיסה
- מסיסות
- אתר כתר
- כלציה
- קריפטנד
- נוזל יוני
- דטרגנט
- חומרים פעילי שטח
- ניקוי יבש
- מים כבדים
- אמלגמה
- כימיה ירוקה
לקריאה נוספת
- George Wypych, Handbook of Solvents, ChemTec Publishing, 2001 (באנגלית)
- Ian Smallwood, Handbook of Organic Solvent Properties, Butterworth-Heinemann, 2012 (באנגלית)
קישורים חיצוניים
- https://www.organicdivision.org/orig/organic_solvents.html
- https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Aldrich/General_Information/labbasics_pg144.pdf
- https://medschool.vanderbilt.edu/sulikowski-lab/files/sulikowski-lab/public_files/Solvent%20Properties.pdf(הקישור אינו פעיל)
- ממס, באתר אנציקלופדיה בריטניקה (באנגלית)
 ממסים, דף שער בספרייה הלאומית
ממסים, דף שער בספרייה הלאומית
הערות שוליים
ממס39372128Q146505