סרטן (מחלה)
| גורם | גורמים מגוונים, וביניהם גורמים ביולוגיים, גנטיים וחיצוניים. ראו בגוף הערך |
|---|---|
| גורמי סיכון | מגוונים, וביניהם עישון, חשיפה לכימיקלים ועוד. |
| טיפול | ראו בערך: הטיפול בסרטן |


סרטן הוא שם כללי למחלות שונות שבהן תאי הגוף מתחלקים בצורה בלתי מבוקרת. הצטברות של תאים כאלה יוצרת גידול ממאיר (נאופלזיה), ובמקרים מסוימים חלק מתאים אלה נודדים למקומות אחרים בגוף ויוצרים גרורות.
מקור המונח הוא בבעל החיים סרטן, וכבר אצל היפוקרטס מתוארים סוגים שונים של מחלות סרטן במילה היוונית καρκίνος (תעתיק: קרקינוס, פירושו: בעל החיים סרטן). גלנוס מציין שסרטן השד נקרא כך בשל דמיונו לצורת סרטן: הגידול נראה כגוף הסרטן, וכלי הדם המקיפים אותו מזכירים את רגלי הסרטן.
שדה המחקר והטיפול במחלת סרטן ברפואה נקרא "אונקולוגיה" (מיוונית - "תורת ההתנפחות"). מחלת הסרטן היא מושא מחקר חשוב עם עליית תוחלת החיים, מפני שהיא מופיעה לרוב אצל מבוגרים, לאחר הצטברות של מוטציות מסוימות בגנום. למרות התקדמות בפיתוח טיפולים נגד סרטן, מיוחסת חשיבות גבוהה לגילוי מוקדם של סרטן בשלביו ההתחלתיים, בהם אחוזי הריפוי מסרטן גבוהים, בעוד סרטן שהתגלה בשלבים מאוחרים בדרך כלל אינו ניתן לריפוי, ועלול להוביל למוות. עם זאת, גם לסקירה לגילוי מוקדם יש מגבלות ולעיתים אף חסרונות, ביניהן איבחון-יתר.[1]
אחת מהסיבות המרכזיות לקושי לטפל בסרטן, ובפרט כשהמחלה חוזרת, היא היכולת של תאי הסרטן לפתח עמידות לתרופות שהמטופל מקבל,[2][3] זאת בשל קצב התרבות גבוה, מה שיוצר מוטציות חדשות בחומר התורשתי שמקנות את העמידות. בצורה דומה חיידקים יכולים לפתח עמידות לאנטיביוטיקה, או נגיפים ההופכים חסינים לחיסון. יש לציין כי התפתחות העמידות בכל אחד מהמקרים לא נובעת בהכרח מאותם מנגנונים.
במטרה לאגד כל המידע בהקשר לחקר המחלה, לנושא הוקצתה סיומת אינטרנט .cancerresearch.
ביולוגיה של גידולים ממאירים
היווצרותו של הסרטן
הסרטן הוא שם אחד למחלה אשר יכולה להתפתח עד כדי השתלטות על כל חלקי הגוף ולכן מיוחסים לה שמות אחרים. גוף מורכב מסוגי תאים רבים ואיננו סטטי. בכל יום מתים תאים ותיקים ותאים חדשים נוצרים באמצעות מיטוזה (התחלקות). בתהליך תקין התאים מתחלקים רק בצורה מבוקרת, כשיש אות הגורם לחלוקה. יכול להיווצר מצב, שבו התאים ממשיכים להתחלק גם כאשר אין צורך בהם ואז הם יוצרים גידול. ישנם שני סוגי גידולים: שפיר (benign) שאיננו הורס את הרקמה ממנה הוא נוצר ואינו מתפשט לרקמות מרוחקות וממאיר (malignant) שהוא גידול סרטני. במקרה זה, מדובר בתאים שאינם נורמליים (כלומר, תאים שה-DNA שבהם פגום, או בעל מוטציה). הפיקוח על חלוקתם נפגע, הם משתלטים על האבר שבו הם מתחלקים ומפריעים לתפקודו ואף מתפשטים לאיברים הסמוכים להם ומפריעים גם לתפקודם. תאים אלה עשויים להופיע מחדש גם לאחר הסרת הגידול המקורי. הם עלולים לפלוש לרקמות מרוחקות באמצעות זרם הדם או הלימפה, להתיישב שם ולגרום להם נזק. תהליך שנקרא גרורה (Metastatis), שאחד ממאפייניה הוא קיום תכונות דומות לגידול הראשוני ממנו התפתחה.
סרטן היא בעיקר מחלה של גנים. בדרך כלל סדרה של מוטציות (שינויים) בגנום, דרושות, על מנת שהתא יהפוך לסרטני. קיימת הבדלה בין גנים הנקראים אונקוגנים, שגורמים להתפתחות סרטן בתאים, בעקבות שינויים בגן, וגנים מעכבי סרטן, שפגיעה בהם מורידה את מערך ההגנה של התא מפני סרטן. מוטציות בגנים אלו יכולות להיגרם על ידי קרינה מייננת, כימיקלים מסרטנים (קרצינוגנים), תורשה של גנים שעברו מוטציה, וירוסים וחיידקים גורמי סרטן ופגיעה על ידי רדיקלים חופשיים.
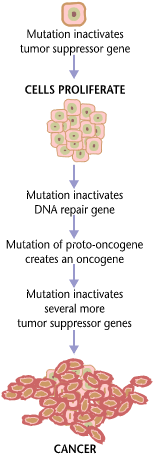
ברוב המקרים לא ניתן לדעת מהו האירוע הראשוני, שגרם לתא להפוך לסרטני. אולם, בביולוגיה מולקולרית ניתן לתאר את המוטציות בגידול, ולצפות את התנהגותו ברמה מסוימת. לדוגמה, כ־50% מהגידולים מראים מחסור של גן מעכב סרטן p53 שנקרא גם "שומר הגנום". לאחר מספר מוטציות בגנום, גן זה יורה לתא להיכנס לאפופטוזה (מוות תאי מבוקר), כדי לא לשמר את המוטציות הפגומות. אי תפקודו של גן זה מאפשר לתאים אלו להמשיך לחיות, ולהתחלק, וכך ליצור עוד תאים שלא מתים. הימצאות טלומרז גורמת לחלוקה אינסופית של התא. מוטציות אחרות מאפשרות לגידולים לפתח רשת כלי דם להספקת חמצן וחומרים מזינים לתא, או להיפרד מהרקמה שהם נמצאים בה ולעבור לרקמה אחרת.
גידולים ממאירים כמו קרצינומה, סרקומה, לימפומה או לוקמיה, מתפתחים מתא או קבוצת תאים, המקיימים אחד או יותר מהתנאים הבאים:
- התחמקות מאפופטוזה
- גיוס כלי דם להזנת הרקמה
- פוטנציאל גדילה אינסופי
- ייצור עצמי של אמצעי גדילה
- חוסר רגישות למעכבי גדילה
- יכולת לחדור לרקמות שכנות
- יכולת התחמקות מהמערכת החיסונית - אך ישנם חוקרים שחולקים על תנאי זה.
לתא ממאיר שישה מאפיינים:
- Self sufficiency in growth signals: לתאים תקינים יש רצפטורים לגורמי גדילה שונים. אם התא לא יקבל גורמי גדילה, באופן נורמלי הוא ימות. לעומת זאת, תאים ממאירים לא זקוקים לגורמי גדילה, היות שהרצפטורים מופעלים באופן אוטונומי. כך למשל, במקרים של לוקמיה מיאלואידית נפוצה, נוצר חלבון (כתוצאה מקיומו של כרומוזום פילדלפיה) אשר משמש כרצפטור טירוזין קינאז ומביא לפרוליפרציה בלתי מבוקרת של התא. הרצפטור יכול להיות משופעל באופן אוטונומי כתוצאה מאונקוגן ששופעל או איבוד פעילות של tumor suppressor gene.
- Insensitivity to growth inhibitor signals: למשל, מוטציות ב-P53. באופן נורמלי תפקידו לעצור את חלוקת התא, כאשר יש בו מוטציה התא ממשיך להתחלק. מוטציה זו קיימת בכ-60% מהממאירויות השונות.
- תא ממאיר עושה פחות אפופוטוזיס - השמדה עצמית. רצפטורים שמטרתם באופן נורמלי לעודד אפופטוזה, כגון TNF-R, FAS-R, עוברים אינאקטיבציה ברבות מסוגי הממאירויות.
- יכולת שכפול בלתי מוגבלת, בעיקר על ידי הפעלה של טלומרז המאריך את הטלומרים.
- אנגיוגנזיס - יכולת ליצור כלי דם חדשים המזינים את הגידול, על ידי ייצור של VEGF (גורם גדילה להיווצרות כלי דם).
- יכולת חדירה לרקמה ויצירת גרורות (מטסטזות), על ידי אינאקטיבציה של E-cadherin.
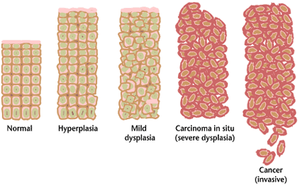
תא ההופך לגידול אינו רוכש בדרך כלל את כל התכונות הללו בבת אחת. אבל תאי הבת שלו נבחרים בברירה הטבעית לבנות אותם. תהליך זה מכונה אבולוציה תאית. הצעד הראשון בהתפתחות של גידול הוא בדרך כלל שינוי קטן ב-DNA, לעיתים תכופות מוטציה אשר מובילה בין יתר הדברים לחוסר יציבות תורשתית של התא. חוסר היציבות מתגברת לנקודה שבו התא מאבד את כל הכרומוזומים[דרושה הבהרה] או מכפיל אותם[דרוש מקור]. בנוסף לכך דפוס המתילציה של התא משתנה. הפעלה וחוסר הפעלה של גנים באופן אקראי. תאים שמתחלקים בקצב גבוה, בתור גזע תא[דרושה הבהרה] מראים סיכון גבוה להפוך לתאים סרטניים מאשר התאים שמתחלקים פחות או יותר באופן רגיל, לדוגמה נוירון. אם תא הגידול הראשוני (או קבוצה של תאים סרטניים) אינה מוסרת באמצעות המערכת החיסונית, היא תתפתח לסרטן.
- השערת תאי הגזע הסרטניים - מספר מחקרים הציעו[דרוש מקור] שהרקמה הסרטנית מורכבת למעשה משתי תת-אוכלוסיות: תאי גזע סרטניים (Cancer Stem Cells) שהם בעלי פוטנציאל ליצור גרורות ותאים סרטניים רגילים (Bulk tumor) שאין להם יכולות ממאירות ונוצרים מתאי הגזע הסרטניים. הרוב המכריע של הרקמה מורכבת מהתאים הסרטניים הרגילים ומקצתה מתאי הגזע הסרטניים. ההשערה מציעה שמקור הגידול הסרטני הוא תא גזע מותמר ושהצלחת הטיפול בגידול אינה צריכה להימדד לפי התכווצותו, אלא לפי היכולת לצמצם את אוכלוסיית תאי הגזע הסרטניים. אם ההשערה נכונה, המחקר האונקוגני כיום עומד בפני מהפכה בכל הקשור להבנת התהליך הסרטני.
גרורה
סרטן מסוגל להתפשט דרך הגוף בשני מנגנונים: התפשטות מקומית וגרורה מרוחקת. התפשטות מתייחסת להתפשטות ישירה של הסרטן לרקמה שכנה ואילו גרורה מתייחסת ליכולת של תאים סרטניים לחלחל דרך קשרי הלימפה וכלי הדם, לנוע בחופשיות דרך מחזור הדם, ולהתפשט לרקמה בריאה במקום אחר בגוף. הסרטן הוא קטלני מאוד כאשר הוא גרורה.
מדדי ממאירות
- חודרנות לתאים מסביב
- קצב גידול מהיר
- התמיינות נמוכה
- שליחת גרורות
הגורמים לסרטן
 ערך מורחב – חומר מסרטן
ערך מורחב – חומר מסרטן
סרטן נגרם על ידי שינויים גנטיים בגרעין התא, תהליך טבעי שעובר הגוף במהלך הזדקנותו.
כיום מקובלת ההנחה שישנם גורמים מסוימים אשר מאיצים שינויים גנטיים בגרעין התא, כגון:
- גורמים כימיים
- גורמים פיזיקליים
- גורמים ויראליים
- גורמים בקטריאליים
- גורמים הורמונליים
- גורמים תורשתיים
- תפקוד לקוי של המערכת החיסונית
גורמים כימיים
מחקרים אפידמיולוגיים בארצות שונות, וגם מחקרים הנעשים לגבי תפוצת הסרטן בקרב קבוצות מהגרים, מצביעים על כך כי מספר גדול של גידולים (שאתות) נגרמים כתוצאה מגורמים סביבתיים, הכוללים גם תרכובות כימיות טבעיות או מלאכותיות. כבר בשנת 1577[דרוש מקור] התגלה הקשר שבין סרטן עור ובין היחשפות לפיח, כשנתגלו מקרים רבים של סרטן בעור כיס האשכים אצל נערים שעבדו כמנקי ארובות ונחשפו חשיפה ממושכת לפיח ולחומר מסרטן הנמצא בו. קרבה לבארות נפט ולבארות גז קשורה בסיכון משמעותי לסרטן דם מסוג ALL אצל ילדים[4] ואחד החומרים המסרטנים החשודים הוא בנזן. בנזן הוא אחד החומרים המסרטנים אליהם נחשפים עובדי בארות הנפט והגז הימיות הרחק מהחוף, שם מופק גם קונדנסאט. חשיפה זו נמצאה קשורה באופן מובהק למיאלומה נפוצה וייתכן גם לסרטני דם נוספים (לוקמיה מילואידית חריפה AML, לוקמיה לימפוציטית כרונית CLL).[5]
כימיקלים רבים הנמצאים במוצרי טבק הם מסרטנים וייתכן שכך גם בעשן קנאביס.[6] עשן הסיגריות מכיל כ-70 חומרים המוגדרים כמסרטנים-בבני-אדם והעישון (כולל עישון פאסיבי[7]) גורם למגוון של מחלות, כולל מחלות סרטן שונות.[8]
רק בשנים 1915–1918 הוכח הקשר בין חשיפה לחומר מסרטן ובין סרטן העור, על ידי משיחה נשנית של עטרן הפחם על עור ארנבות. כעבור שנים מספר בודד החומר המסרטן הראשון - "בנזנתרצן 1" ולאחריו "בנזנתרצן 2", ומאז זוהו עוד מאות חומרים שגרמו סרטן בחיות מעבדה, בתרביות תאים ובאדם.
נוסף על המסרטנים המלאכותיים, יש גם מסרטנים טבעיים, כגון אפלטוקסין - רעלן המופרש על ידי עובשים מסוימים מהסוג אספרגילוס (נמצא קשר בינו ובין סרטן כבד).[9] עובשים אלו מדביקים סוגים שונים של גידולים חקלאיים כמו תירס, בוטנים ואגוזים. איננו מכירים את כל החומרים המסרטנים המצויים בסביבה, ועדיין אין מבחן כימי רחב טווח המזהה חומרים מסרטנים.
חלק מהתרופות בשימוש הרפואה הן מסרטנות או חשודות כמסרטנות. דוגמאות כוללות נוגדי-חומצה כמו אומפרזול, המגביר סיכון לסרטן קיבה,[10][11] תרופות הורמונליות כגון דוטסטרייד (להקטנת ערמונית) שנמצאו כמגבירות התקדמות סרטן ערמונית בטיפול של מעל שנתיים,[12] תרופות נגד אפילפסיה, כמו פניטואין, החשוד בהגברת סיכון לסרטני לימפה, נוירובלסטומה,[13] נוגדי לחץ דם מסוג ARB (בהשוואה לפלצבו נמצאה עליה של בין 0% ל-18% בשכיחות סרטן[14]; ובמיוחד בשילוב עם חוסמי ACE[15]), תרופות ציטוטוקסיות (כימותרפיה)[16] ומדכאות-חיסון, כמו ציקלוספורין (בעיקר סרטני עור[17]) ועוד.
גורמים פיזיקליים
חשיפה לקרינה אלקטרומגנטית מייננת כמו קרני רנטגן עלולה לגרום לסרטן. חשיפה לחומרים רדיואקטיביים הפולטים קרינות מסוגים: אלפא, בטא וגמא עלולה לגרום לנזקים בחומר הגנטי של התאים. אבחון הנזק על ידי מנגנון פנימי בתא מונע חלוקה של התא עד לתיקונו, לחלופין אם הנזק גדול מדי התא מתאבד. במקרה שהנזק הגנטי נוצר לקבוצת חלבונים (P53) מסוימת המתווכת את ההוראה לאפופטוזה התא שומר על הנזק הגנטי וממשיך בריבוי. אם המערכת החיסונית לא תוקפת את התא, יכול להיווצר גידול סרטני.
הקשר בין חשיפה לקרינה והתפתחות סרטן מבוססים בעיקר על אוכלוסיות שנחשפו לכמויות גבוהות יחסית של קרינה מייננת כמו ניצולים מן הפצצות האטומיות שהוטלו על יפן, אנשים שנחשפו לקרינה בכורים גרעיניים, ואנשים שעברו טיפולים רפואיים בקרינה מייננת לצורך אבחון (צילומי רנטגן, ממוגרפיה, צפיפות עצם, סי.טי.) או ריפוי (רדיותרפיה). גם חשיפה בלתי מבוקרת לקרינת השמש עלולה גם היא לגרום למלנומה שהיא סרטן העור.
חשיפה לקרינה בלתי מייננת ברמות גבוהות כמו למשל חשיפה לקרני מיקרוגל הנפלטים מאנטנות שידור נחשבת בעיני הציבור כגורם אפשרי לסרטן למרות עמדת ארגון הבריאות העולמי, קרינה זאת היא זהה לקרינה מהטלפון הסלולרי, עם זאת לא נמצאו מחקרים המעידים על קשר ישיר בין שימוש בטלפון סלולרי לסרטן המוח (ראו ערך מורחב: השפעות בריאותיות של קרינת טלפון סלולרי).
גורמים נגיפיים (וירוסים) וחיידקיים (בקטריות)
כבר בתחילת המאה ה-20 נמצא קשר ישיר בין נגיפים לסרטן בחיות מעבדה. תחילה הוכח כי סרטן הדם (לוקמיה) וסרקומה (גידול ממאיר שמקורו בעצם, בסחוס או ברקמת חיבור אחרת) עלולים להיגרם על ידי נגיף. רק בשנות ה-50 הצליחו לבודד נגיף אונקוגני ראשון, נגיף הפוליומה. הקושי הגדול בהוכחת הקשר בין נגיף לסרטן נעוץ בעובדה שהימצאות נגיף ברקמה סרטנית איננה הוכחה שהנגיף גרם את הסרטן, שכן נגיפים מצויים גם ברקמות תקינות שונות של בעלי חיים; ולעיתים הנגיף רק "מתאחסן" ברקמה.
עם זאת, כמה נגיפים ידועים כמחוללי סרטן אצל בני אדם, ונגיפים אחרים חשודים בכך. נגיף הצהבת C ידוע כגורם לסרטן כבד, נגיפים ממשפחת הפפילומה ידועים כגורמים לסרטן צוואר הרחם, נגיף הCMV כגורם סרקומת קפוסי, וירוס אפשטיין בר כגורם ללימפומת בירקיט, ונגיף ה-HIV כגורם ללימפומות וגידולים סרטניים אחרים במערכת הדם.[18]
חיידק הליקובקטר פילורי, שעשוי לגרום לזיהום קיבה כרוני, הוא גורם הסיכון הידוע המשמעותי ביותר לסרטן קיבה.[19] עדויות עקיפות מצביעות גם על קשר אפשרי בין דלקת חניכיים וחיידקי הפה לבין סרטן הלבלב וסרטנים נוספים.[20][21]
גורמים הורמונליים
מחקרים עדכניים על הקשר בין הורמון גדילה והזדקנות מצביעים על כך, שככל שתאי המטרה קולטים יותר הורמון גדילה, הם מזדקנים יותר, ובהתאמה גם הגוף כולו חולה יותר במחלות הקשורות להזדקנות, לרבות ובמיוחד סרטן. עוד מסתבר, שגם ההפך נכון, דהיינו, מניעת קליטת הורמון גדילה בתאי המטרה יכולה למנוע סרטן. חולים בתסמונת לרון למשל, אינם חולים כמעט לעולם בסרטן. מחקר על 99 חולי לרון שכאלה, במשך 24 שנים גילה אשה אחת בלבד אצלם, שחלתה בסוג כלשהו של סרטן.[22][23][24]
גורמים סביבתיים
גורמים סביבתיים, כגון זיהום אוויר, עלולים לעלות את תחלואת הסרטן באזורים גאוגרפים מסוימים. מחקרים של משרד הבריאות מראים שתחלואת הסרטן בנפת חיפה גבוה בשיעור של בין 15% ל-20% משאר הארץ. שוני זה נשאר יציב משנת 1984. אחת ההשערות לתחלואה העודפת של סרטן במפרץ חיפה היא שזיהום האוויר החריג במפרץ חיפה הוא הגורם שמסביר את התחלואה הגבוהה בסרטן. בשנת 2015 פורסם כי העיר חיפה מציגה את תחלואת הסרטן הגבוהה ביותר ב-OECD [25] הסוקר קשר אפשרי זה בין זיהום האוויר לתחלואת הסרטן בנפת חיפה.
צורות של סרטן
מושג הסרטן רחב מאוד וכולל מחלות שונות. חלקן, אם מתגלות במצב מוקדם, ניתנות בדרך כלל לטיפול מהיר, וחלקן קשות יותר:
- סרטן של מערכת העצבים
- סרטן של מערכת הראייה
- סרטן באזור הראש והצוואר
- סרטן של מערכת הנשימה
- סרטן הריאה
- סרטן הגרון
- מזותליומה ממאירה - סרטן קרום הצדר
- סרטן של מערכת הקול
- סרטן מיתרי הקול
- סרטן הענבל (נדיר)
- סרטן של מערכות הדם והלימפה (המטולוגי)
- סרטן הדם/לוקמיה
- לוקמיה לימפוציטית חריפה (ALL)
- לוקמיה לימפוציטית כרונית (CLL)
- לוקמיה מיאלואידית חריפה (AML)
- לוקמיה מיאלואידית כרונית (CML)
- לימפומה
- מיאלומה נפוצה
- סרטן הלב (נדיר)
- סרטן השקדים (נדיר)
- סרטן הדם/לוקמיה
- סרטן העור
- סרטן של מערכת השלד
- סרטן בדרכי השתן
- סרטן של אזור החזה
- סרטן של מערכת העיכול
- סרטן של מערכת הרביה הנקבית
- סרטן השחלה
- סרטן הרחם
- סרטן צוואר הרחם
- סרטן רירית הרחם
- סרטן באיבר הרבייה
- סרטן החצוצרות
- כוריאוקרצינומה
- סרטן של מערכת הרביה הזכרית
- סרטן בלוטת הערמונית
- סרטן האשכים
- סרטן באיבר הרבייה
הטיפול בסרטן
דרכי הטיפול בסרטן הן:
- טיפול כירורגי
- טיפול בקרינה (רדיותרפיה)
- טיפול כימי (כימותרפיה)
- טיפול חיסוני (אימונותרפיה)
- טיפול הורמונלי (הורמונתרפיה)
- הכחדת גידול באמצעות גלי מיקרו
הטיפול הכירורגי
הטיפול הכירורגי בסרטן כולל ניתוח להסרת הגידול. זהו הטיפול הראשוני היעיל ביותר ברוב מקרי הגידולים הממאירים (השאתות הממאירות). עם זאת, יש גידולים (שאתות) שהטיפול הראשוני היעיל ביותר להם הוא טיפול תרופתי (כימותרפיה) או טיפול קרינתי (רדיותרפיה). הטיפול הכירורגי הרדיקלי מוגבל לגידולים (שאתות) ממוקמים, שטרם פרצו את גבולות האיבר שבו הם צמחו, אך לפעמים יועיל ניתוח גם כשהמחלה התפשטה לבלוטות הלימפה האזוריות.
ככל שהגידול (שאת) הראשוני גדול יותר, רבה יותר ההסתברות שהוא פיזר גרורות דרך כלי הלימפה והדם. גידולים (שאתות) שגודלם עולה על גודל מסוים נחשבים לבלתי-ניתנים להסרה כירורגית. אמנם מבחינה טכנית ניתן להסירם, אך ההסרה לא תאפשר לאיבר להוסיף ולהתקיים, וכריתת האיבר במקרה זה אינה מעלה את תוחלת החיים של החולה ולעיתים אף יכולה לגרום נזק. אף על פי כן, לעיתים מבצעים ניתוח פליאטיבי (ניתוח מקל, ניתוח משכך) העשוי להקל על החולה אך לא להאריך את תוחלת חייו (לדוגמה, כריתת שאת החוסם את המעי הגס, אף על פי שגרורותיה כבר נתגלו בכבד). הטיפול הכירורגי יעיל ביותר לריפוי סרטן הממוקם באיברים כגון השדיים, המעי הגס והרחם. לפני הניתוח יש לערוך בדיקה מקיפה ויסודית ולוודא את ממדי התפשטות השאת.
הטיפול בקרינה
הטיפול בקרינה או הטיפול הרדיותרפי הוא הטיפול השני בחשיבותו לאחר הטיפול הכירורגי, ויש גידולים (שאתות) ממאירים רבים, שהטיפול בהן בקרינה שקול בערכו לכריתה בניתוח או אף יעיל יותר. הטיפול בקרינה עשוי לפטור את החולה מניתוח פולשני, מכריתת איברים או רקמות ומנכות כרונית.
מטרת הקרינה היא לגרום לנזק גנטי מכוון ומשמעותי לרקמה שמכילה תאים סרטניים. תאים בעלי נזק גנטי הבלתי ניתן לתיקון עצמי יתאבדו (אפופטוזה). לעיתים, הסרטן נגרם בגלל מוטציה פרטנית בגן שאחראי על הפעלת מנגנון ההתאבדות התאית, ומכאן היעילות החלקית של הקרנה בטיפול.
החוקר השוודי סטרנדקיוסט (Strandquist) עיבד ופרסם בשנת 1944 נתונים מתוכניות טיפול רדיולוגיות שונות בשאתות ממאירים בעור ובשפתיים. הוא התווה בעקומות את הקשר בין מנת הקרינה ובין משך הטיפול, ומצא יחס בסיסי בין שני גורמים אלה: כאשר מנת הקרינה אחידה במשך תקופה ארוכה מדי, יעילותה פוחתת, ומאידך, אותה מנה בזמן קצר מאוד גורמת תגובת קרינה ברקמות. עוד מצא החוקר יחס זמן-מנה המאפשר ריפוי ללא נזקי קרינה. הקשר בין מנת הקרינה, הזמן ומספר ההקרנות מסוכם כיום בנוסחה מתמטית שפותחה בשנות ה-60 של המאה ה-20, ולמעשה אפשר כיום לתמרן את הטיפול בקרינה לפי הנסיבות, אגב שמירת העיקרון הבסיסי של מניעת נזק לרקמות התקינות, עד כמה שאפשר.
מקור הקרינה הראשון היה קרני רנטגן, שנתגלו בשנת 1895. ואולם הטיפול בקרינה זו היה כרוך בנזק לרקמות התקינות. עקרון פעולתה של מכונת הרנטגן הוא כזה: אלקטרונים מואצים על ידי מפל מתח חשמלי גבוה בשפופרת רִיק ופוגעים במטרה העשויה ממתכת כבדה (כגון טונגסטן); עקב הפגיעה משתחררות קרני X בטווח רחב של אנרגיה. ככל שהאנרגיה גבוהה יותר, אורך הגל קצר יותר; ככל שאנרגיית הקרן גבוהה יותר, הקרן מסוגלת להעמיק יותר ברקמות. כאשר הקרן עוברת ברקמות, היא מאבדת אנרגיה בהדרגה. במשך השנים פותחו מכונות רנטגן טובות יותר (בתחילה של 140KV [קילו וולט=KV], ואחר כך של 200KV). עם המכשירים היותר משוכללים ניתן היה להגיע לרקמות עמוקות יחסית.
בד בבד עם פיתוח מכונות הרנטגן, החל פיתוח של מכשירי קרינה רדיואקטיביים: מחטים או שפופרות עשויות רדיום, שהוחדרו לתוך הגידול (שאת) או נערכו באגודות על גבי גידולים (שאתות) שטוחים. צורת טיפול זו קרויה "טיפול מקרוב" או "ברכיתרפיה" (Brachytherapy), והיא נהוגה עד היום בגידולים (שאתות) מסוימים, כגון גדולים ממאירים בשני השלישים הקדמיים של הלשון ובצוואר הרחם. אך במקום הרדיום (העלול להיות מסוכן אם נוצר סדק במעטהו ונפלט גז רדון) החליפו כיום חומרים רדיואקטיביים אחרים, כגון קובלט 60 וצסיום 137 (איזוטופ הפולט קרינת Y; קרינתו:660KV). ניסיונות לטיפול מרחוק בעזרת רדיום נכשלו עקב מחירו הגבוה של החומר והקושי הטכני לרכזו בכמות יעילה מטווח רחוק (Teletherapy).
בשנות ה-70 של המאה ה-20 שבו לשיטת הטיפול מקרוב. הדבר נתאפשר בזכות פיתוחם של איזוטופים רדיואקטיביים הפולטים קרינה קצרת טווח, טכניקות חדשות של החדרת החומר הרדיואקטיבי לרקמות בדיוק וללא סיכון הצוות המטפל, ושיטות חישוב חדישות של מנת הקרינה בעזרת מחשב. כיום משמשת טכניקה זו לריפוי גידולים מסוימים; בגידולים אחרים הטיפול הוא עדיין ניסיוני. כיום נהוגות גם מכונות קרינה הפולטות אלומות של חלקיקים כבדים, כגון הציקלוטרון, המאיץ פרוטונים שבהם ניתן להשתמש ישירות, או גורם לפליטה של נייטרונים ממטרות בריליום בהן פוגעים פרוטונים או חלקיקים טעונים אחרים שהואצו.
צוות הטיפול הרדיותרפי מקיף רופא, פיזיקאי וטכנאים. מינון הקרינה מבוסס על לוחות איזידוזות (איזידוזה=מנה שווה) - מפות המבטאות את אחוז הקרינה בעומק השדה יחסית למנה בשטח המוקרן. החישוב המורכב נעשה בדרך כלל במחשב מחלקתי המצוי בכל מחלקה רדיותרפית מודרנית. לאחר שמזינים את המחשב בנתוני החולה, שדה הקרינה, מכשיר הקרינה ומקום הגידול, המחשב מספק תוכנית הקרנה מיטבית מבחינת המינון. הסימולטור מאפשר לשקף את האזור הנגוע ולסמן את שדה הטיפול בדייקנות, והטומוגרף הממוחשב מאפשר, באמצעות תצלומי מחתך של הגוף, לאסוף מידע על היחס בין אתר הגידול ובין הרקמות הבריאות.
טיפול כימותרפי
 ערך מורחב – כימותרפיה
ערך מורחב – כימותרפיה
הטיפול התרופתי או הטיפול הכימותרפי הוא בעיקר טיפול עזר לטיפול בהקרנה. באמצעות תכשירים ציטו-טוקסיים (רעילים לתאים) ניתן לערער את מבנה גדילי ה-DNA וה-RNA של תאים ממאירים וניתן לעשותם פגיעים יותר לקרינה. ניסיון מצטבר של השנים האחרונות מלמד שאפשר לשפר את תוחלת החיים של חולים שלקו בסוגי סרטן מסוימים על ידי טיפול משולב של הקרנה ותכשירים ציטו-טוקסיים.
תופעות הלוואי של מקצת התרופות היא ירידה בתפקוד מח העצם, אך אפשר למנוע חסר תאים אדומים, לבנים וטסיות, או לטפל בחסר כזה, על ידי מתן אריתרופויאטין, חומרים המגבירים את ייצור תאי הדם הלבנים ותרומבופויאטין.
היום פותחו תרופות להתמודדות עם הבחילות, הצרבות וההקאות, ולכן ברוב המקרים החולה ירגיש תופעות לוואי פחות קשות מבעבר. בחילות, צרבות והקאות מטופלות על ידי תרופות כגון:
- גסטרו
- פארמין
- זנטקס
- סיטרון
אימונותרפיה
 ערך מורחב – אימונותרפיה
ערך מורחב – אימונותרפיה
טיפול חיסוני או טיפול אימונותרפי הוא טיפול המבוסס על הפעלת גורמים שונים במערכת החיסון, תוך כדי חיזוקה והגברתה, כנגד גידול הסרטני או גורמים המסייעים לו. יש מספר רב של דרכים תאורטיות לעורר את הגוף ליצירת תגובה חיסונית כנגד תאי הסרטן - הזרקה של תאי הסרטן מוקרנים, הזרקת ציטוקינים המעוררים את המערכת החיסונית, הזרקת תאי דם שונים (בעיקר לימפוציטים מסוג T תת-אוכלוסייה CD8) והזרקת נוגדנים. מכל הטיפולים הללו רק טיפול בנוגדנים נמצא בשימוש נרחב.
הטיפול בנוגדנים מבוסס על העובדה כי תאי סרטן מבטאים חלבונים מסוימים שאינם נמצאים בתאים בוגרים נורמליים או שמצויים בכמות גדולה בתאים סרטניים. כנגד חלבונים אלו (Tumor specific antigen) פותחו נוגדנים מואנשים, הנוגדנים נקשרים לחלבון, מנטרלים את פעולתו וחושפים את התא הסרטני למנגנוני תקיפה שונים של מערכת החיסון. בין הנוגדנים המואנשים הידועים נמצא ההרצפטין - נוגדן נגד החלבון HER-2 המעכב גידולים בחולות סרטן השד.
טיפול חדשני, העושה שימוש בווירוסים גורמי איידס מוחלשים, המפעילים לימפוציטים מסוג T, נוסה בארצות הברית והוכיח הצלחה גדולה בריפוי סרטן הדם. הטיפול נמצא עם זאת, עדיין, בשלבי ניסוי. טיפול אחר, העושה שימוש בחיידקי שחפת מוחלשים, המגרים את מערכת החיסון לפעולה, קיים ונפוץ בשימוש ברפואה מזה כשלושים שנה והוכיח הצלחה במניעת חזרת סרטן שלפוחית השתן.
טיפול אנטי-אנגיוגני
הטיפול האנטי-אנגיוגני אינו מכוון ישירות כנגד הגידול הסרטני עצמו, אלא מונע יצירת כלי-דם חדשים. הרקמה הסרטנית זקוקה לחמצן וחומרי גלם על מנת להתפתח ועל כן מפרישה גורם המזרז יצירת כלי דם באזור המכונה VEGF - Vascular Endothelial Growth Factor. חסימת VEGF גורמת להרעבת הגידול ומונעת ממנו להתפתח ואף גורמת לו להתכווץ.
הטיפול האנטי-אנגיוגני הוצע כבר בתחילות שנות ה-70, אך התקבל בספקנות בקהילה המדעית, היות שהקונספציה העיקרית הייתה טיפול ישיר בתאים הסרטניים. רק בשנת 1996 הוכח שחסימת הפקטור באמצעות נוגדנים חד-שבטיים פוגע בגידול. ב-2004 אישר מינהל התרופות והמזון האמריקאי תרופה בשם בוואציזומאב (אווסטין) המורכבת מאותם נוגדנים חד-שבטיים כנגד VEGF. הטיפול מיועד כיום בעיקר לסובלים מסרטן המעי הגס גרורה, וניתנת בשילוב עם כימותרפיה. הרעיון של תקיפה עקיפה של הגידול הסרטני יצר שינוי גישה בקהילה האונקולוגית וכיום נעשים מאמצים רבים להבין את הקשר בין הגידול הסרטני לבין המיקרו-סביבה שבה הוא שוכן.
מניעת הסרטן
מחלות סרטן שונות ניתנות למניעה על ידי הקפדה על ארבעה דברים עיקריים: בדיקות מקדימות כמו קולונסקופיה, חיסונים כמו חיסון פפילומה, שמירה על סביבה נטולת קרצינוגנים כמו עישון או זיהום והקפדה על תזונה מאוזנת שכוללת ירקות וקטניות, בדגש על ירקות ממשפחת המצליבים (כרוב, כרובית, ברוקולי), שום, כורכום, עגבניות (בעיקר מבושלות), אגוזים ועוד, לצד פעילות גופנית יומיומית מרובה.
ראו גם
- כאב אונקולוגי
- דירוג גידול סרטני
- HIV נגד לוקמיה
- שחפת נגד סרטן שלפוחית השתן
- סינדרום פרה-נאופלסטי
- תזונה וסרטן
- מחלה שארית מינימלית
- סרטן ראש צוואר
- סרטן ילדות
לקריאה נוספת
- ד"ר רוברט ברקוב (עורך ראשי), מֶרְק - המדריך הרפואי השלם, בהוצאת כנרת זמורה ביתן דביר והד ארצי, 2002, עמ' 805-789
- רחל טלשיר, המחלה ההיא, עם עובד, 2007
- דויד סרואן שרייבר, לא לסרטן, מודן, 2008
- יעקב שהם, הסרטן כאתגר: תגליות מדעיות ותובנות חדשות - מקור לתקווה, מודן, 2013. אוניברסיטה משודרת, 2013.
- סידהרתא מוקרג'י, מלכת כל המחלות: ביוגרפיה של מחלת הסרטן. (The Emperor of all Maladies: A Biography of Cancer) מאנגלית: יוסי מילוא. עם עובד 2013. מסת"ב 978-965-13-2340-9
קישורים חיצוניים
- הרישום הלאומי לסרטן של משרד הבריאות
- רפואה משלימה וסרטן, באתר האגודה למלחמה בסרטן
 חקר הסרטן במכון ויצמן, 1953
חקר הסרטן במכון ויצמן, 1953- רחל טל שיר, המחלה ההיא, באתר הארץ, 21 ביולי 2005
- מיטל יסעור בית-אור, דו"ח למ"ס: מהן סיבות המוות הנפוצות בישראל?, באתר ynet, 19 באוגוסט 2009
- ארז גרטי, המלחמה בסרטן – האם אנחנו מנצחים או מפסידים?, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 30 באוגוסט 2009
- ארז גרטי, נושא החודש אוקטובר 2010 – מחלת הסרטן, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 24 בספטמבר 2010
- בת־חן אפשטיין אליאס, מחפשים תרופה לסרטן, באתר ישראל היום, 28 בדצמבר 2012
- חולי סרטן, באתר כל זכות
- אשכול כתבות על מחקרים בנושא הסרטן, באתר "הידען"
- להתמודד עם הסרטן- שיחה עם יו"ר האגודה למלחמה בסרטן, במסגרת התוכנית "רפואתיקה" של אוניברסיטת חיפה ו"רדיו חיפה" (ינואר 2010)
- ארז גרטי, הפנים האמיתיות של הטיפולים האלטרנטיביים לסרטן, מכון דוידסון, 27 בדצמבר 2017
- פרופ' יוסי ציגלר, היסטוריה של הסרטן: הגילוי והטיפול במחלה שהרגה מיליונים ברחבי העולם, באתר מאקו, 10 באוקטובר 2021
- הערך "סרטן", באתר ויקירפואה
- סרטן, באתר אנציקלופדיה בריטניקה (באנגלית)
 סרטן, דף שער בספרייה הלאומית
סרטן, דף שער בספרייה הלאומית
הערות שוליים
- ↑ Stacy M. Carter, Alexandra Barratt, What is overdiagnosis and why should we take it seriously in cancer screening?, Public Health Research & Practice 27, 2017-07-26 doi: 10.17061/phrp2731722
- ↑ ד"ר דנה יפה, מחקר: טיפול נגד עמידות לטיפול, במדור "חדשות מדע" באתר של מכון דוידסון לחינוך מדעי, 29 בינואר 2019
- ↑ שירות הידען, העמידות של גידולים סרטניים מסוימים לכימותרפיה נובעת מקשריהם עם תאי הגוף הבריאים, באתר "הידען", 23 באוגוסט 2014
- ↑ Lisa M. McKenzie, William B. Allshouse, Tim E. Byers, Edward J. Bedrick, Childhood hematologic cancer and residential proximity to oil and gas development, PloS One 12, 2017, עמ' e0170423 doi: 10.1371/journal.pone.0170423
- ↑ J S Stenehjem, K Kjærheim, M Bråtveit, S O Samuelsen, Benzene exposure and risk of lymphohaematopoietic cancers in 25 000 offshore oil industry workers, British Journal of Cancer 112, 2015-04-28, עמ' 1603–1612 doi: 10.1038/bjc.2015.108
- ↑ Daniel W. Bowles, Cindy L. O'Bryant, D. Ross Camidge, Antonio Jimeno, The intersection between cannabis and cancer in the United States, Critical Reviews in Oncology/Hematology 83, 2012-7, עמ' 1–10 doi: 10.1016/j.critrevonc.2011.09.008
- ↑ S. Schick, S. Glantz, Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke, Tobacco Control 14, 2005-12, עמ' 396–404 doi: 10.1136/tc.2005.011288
- ↑ משרד הבריאות, נזקי העישון, באתר www.health.gov.il, 26-01-2019
- ↑ Aflatoxins, National Cancer Institute (באנגלית)
- ↑ K G Wormsley, Antisecretory drugs and gastric cancer, British Medical Journal (Clinical research ed.) 291, 1985-11-23, עמ' 1504
- ↑ Nele Brusselaers, Karl Wahlin, Lars Engstrand, Jesper Lagergren, Maintenance therapy with proton pump inhibitors and risk of gastric cancer: a nationwide population-based cohort study in Sweden, BMJ Open 7, 2017-10-30 doi: 10.1136/bmjopen-2017-017739
- ↑ Gerald L. Andriole, David G. Bostwick, Otis W. Brawley, Leonard G. Gomella, Effect of Dutasteride on the Risk of Prostate Cancer, New England Journal of Medicine 362, 2010-04-01, עמ' 1192–1202 doi: 10.1056/NEJMoa0908127
- ↑ Gagandeep Singh, Pablo Hernáiz Driever, Josemir W. Sander, Cancer risk in people with epilepsy: the role of antiepileptic drugs, Brain: A Journal of Neurology 128, 2005-1, עמ' 7–17 doi: 10.1093/brain/awh363
- ↑ Yun-Tao Zhao, Peng-Yang Li, Jian-Qiang Zhang, Lei Wang, Angiotensin II Receptor Blockers and Cancer Risk, Medicine 95, 2016-05-06 doi: 10.1097/MD.0000000000003600
- ↑ Sripal Bangalore, Sunil Kumar, Sverre E. Kjeldsen, Harikrishna Makani, Antihypertensive drugs and risk of cancer: network meta-analyses and trial sequential analyses of 324,168 participants from randomised trials, The Lancet. Oncology 12, 2011-1, עמ' 65–82 doi: 10.1016/S1470-2045(10)70260-6
- ↑ P. J. Sessink, R. P. Bos, Drugs hazardous to healthcare workers. Evaluation of methods for monitoring occupational exposure to cytostatic drugs, Drug Safety 20, 1999-4, עמ' 347–359 doi: 10.2165/00002018-199920040-00004
- ↑ דקסל בע"מ, דקסימון, עלון לצרכן, באתר מאגר התרופות אגף הרוקחות - The Israeli Drug Registry, 12/2016
- ↑ במדריך הרפואי מרק ע' 791
- ↑ Lydia E. Wroblewski, Richard M. Peek, Keith T. Wilson, Helicobacter pylori and Gastric Cancer: Factors That Modulate Disease Risk, Clinical Microbiology Reviews 23, 2010-10, עמ' 713–739 doi: 10.1128/CMR.00011-10
- ↑ Dominique S. Michaud, Zhuxuan Fu, Jian Shi, Mei Chung, Periodontal Disease, Tooth Loss, and Cancer Risk, Epidemiologic Reviews 39, 2017-1, עמ' 49–58 doi: 10.1093/epirev/mxx006
- ↑ Dominique S. Michaud, Jacques Izard, Charlotte S. Wilhelm-Benartzi, Doo-Ho You, Plasma antibodies to oral bacteria and risk of pancreatic cancer in a large European prospective cohort study, Gut 62, 2013-12 doi: 10.1136/gutjnl-2012-303006
- ↑ הניו יורק טיימס, 16 בפברואר 2011
- ↑ טיים מגזין, 17 בפברואר 2011
- ↑ Gene Mutation Key To Ecuador Group's Health
- ↑ העיר חיפה מציגה: תחלואת הסרטן הגבוהה ביותר ב-OECD
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
סרטן (מחלה)38705139Q12078


