עמידות לאנטיביוטיקה

עמידות לאנטיביוטיקה היא היכולת של חיידקים לעמוד בפני השפעת אנטיביוטיקה. קיימות מספר קבוצות אנטיביוטיקה, השונות זו מזו בדרך פעולתן על חיידקים. חיידקים שפיתחו עמידות למספר קבוצות אנטיביוטיקה נקראים בעגה חיידקי על (Super Bug). מכיוון שהשימוש באנטיביוטיקה הוא כיום הכלי העיקרי למאבק במחלות ממקור חיידקי, קיימת סכנה של התפתחות חיידקים עמידים לכל סוגי האנטיביוטיקה שלא ניתן יהיה לטפל בהם. דוגמה לכך היא התפרצות של חיידק Klebsiella pneumoniae עמיד לקרבפנם[1] שהתרחשה בבתי חולים בישראל בשנת 2006. ההתפרצות המדווחת הקודמת של חיידקי Klebsiella עמידים לקרבפנם התרחשה בארצות הברית בשנת 2001. קרבפנם היא אנטיביוטיקה לטווח רחב, הנוחלת הצלחה כמעט כנגד כל סוגי החיידקים, לרבות אלו המפתחים עמידות בפני תרופות אנטיביוטיות אחרות. מסיבה זו משתמשים בקרבפנם רק במקרים שטיפולים אנטיביוטיים אחרים נכשלו; אך התפרצויות אלה הראו כי עם הזמן מפתחים החיידקים עמידות גם אליה.
עמידות מולדת (אינטרינסית) לאנטיביוטיקה בחיידקים מתפתחת באמצעות עקרון הברירה הטבעית. כלומר, חשיפה חוזרת ונשנית של אוכלוסיית חיידקים לאנטיביוטיקה מסוימת (או למספר סוגי אנטיביוטיקה) גורמת למות החיידקים הרגישים לה, אך במקביל מתפתחים חיידקים עמידים על ידי מוטציות אקראיות. עם הזמן מתקבלת אוכלוסייה של חיידקים עמידים. יתר על כן, עמידות לאנטיביוטיקה יכולה לעבור בין חיידקים שונים גם בתהליך של העברה גנטית אופקית, שבה קולטים חיידקים גנים מהסביבה או מחיידקים אחרים.
היסטוריה
אנטיביוטיקה מיוצרת באופן טבעי על ידי אורגניזמים שונים. עם גילוי הפניצילין על ידי אלכסנדר פלמינג בשנות ה-20 של המאה ה-20, החלו להשתמש בה ברפואה, אך שימוש מסחרי באנטיביוטיקה החל רק בתקופת מלחמת העולם השנייה. עם פיתוח טכנולוגיות חדשות (ביולוגיות ותעשייתיות) שאפשרו ייצור תעשייתי של פניצילין וסוגי אנטיביוטיקה אחרים בשנות ה-50 של המאה ה-20, הפך השימוש באנטיביוטיקה לנפוץ. כבר בשנות ה-40[2] התברר כי זנים מסוימים של חיידקים פיתחו עמידות כלפי אנטיביוטיקה (בייחוד כלפי הפניצילין). כדי להתמודד עם חיידקים אלו היה צורך לפתח סוגי אנטיביוטיקה הפועלים בדרכים שונות[דרוש מקור]. כיום קיימים זני חיידקים עמידים לרוב סוגי האנטיביוטיקה. מצב זה הביא ל"מרוץ חימוש" אבולוציוני, כאשר מצד אחד האדם מפתח סוגי אנטיביוטיקה חדשים, ומצד שני מתפתחים זני חיידקים עמידים להם, וחוזר חלילה.
בגוף האדם נמצאות אוכלוסיות חיידקים שהגוף זקוק להן, לדוגמה חיידקים סימביוטיים במערכת העיכול, הנפגעות אף הן מאנטיביוטיקה. דבר זה מהווה בעיה בשימוש באנטיביוטיקה, מכיוון שיש לאזן בין הצורך לפגיעה יעילה בחיידקים הפתוגניים לבין הצורך לשמור על החיידקים המועילים.
התמודדות עם חיידקים עמידים לאנטיביוטיקה
על מנת להתמודד עם עמידות חיידקים לאנטיביוטיקה נשקלים ומפותחים כיווני מחקר שונים.
- שימוש בפפטידים אנטימיקרוביאליים. פפטידים ידועים כגורמים חשובים במערכת החיסון הכללית[3], וניתן לייצר אותם באופן תעשייתי.
- שימוש בבקטריופאג'ים כנגד חיידקים.
מנגנוני עמידות לאנטיביוטיקה
חמשת המנגנונים המרכזיים לעמידות לאנטיביוטיקה במיקרואורגניזמים:
- שינוי או פירוק של האנטיביוטיקה: כדוגמת ייצור בטא לקטמאז המבטל את פעולתו של פניצלין G באמצעות הידרוליזה של טבעת בטא לקטם (הנמצאת באנטיביוטיקות שונות בהן פניצילין, אמוקסיצילין וצפלוספורין).
- שינוי באתר המטרה: כדוגמת שינויים בחלבונים קושרי פניצלין (PBP). לדוגמה פניצילין ונגזרותיו, מפריעות להרכבת הפפטידוגליקן, ובמיוחד לפעולתו של טרנספפטידאז, ובכך פוגעות בהרכבת דופן תא החיידק בעת חלוקה. מוטציות הגורמות לשינויים בטרנספפטידאז, ובעקבות זאת מפריעות לאינטראקציות בינו לבין התרופה האנטיביוטית הם דוגמה לסוג זה של מנגנון עמידות. לדוגמה סטאפילוקוקוס זהוב עמיד למתיצילין (MRSA).
- שינויים במסלול המטבולי: חיידקים העמידים לסולפונאמיד לא זקוקים לחומצה פרה אמינו בנזואית (para-aminobenzoic acid; PABA), המשמשת לסנתוז חומצה פולית וחומצות אמינו בחיידקים. במקום זאת, בדומה לתאים של יונקים, הם מנצלים חומצה פולית מוכנה.
- צבירה פחותה של אנטיביוטיקה: באמצעות הפחתת החדירות של האנטיביוטיקה לתא, או הגברת שטף החוצה (efflux; הוצאת האנטיביוטיקה מן התא).
- באנטיביוטיקות שפועלות על תאים מתחלקים, הסתבר שישנה תת-אוכלוסייה שלא מתחלקת בשלב הגידול המעריכי, ולאחר סילוק האנטיביוטיקה, תת-אוכלוסייה זו יכולה לשוב ולהוות גרעין התרבות[4], אשר החיידקים שיגדלו ממנו לא יהיו עמידים בעצמם. עמידות זו הא איננה מוּרשת ואיננה מעורבת בשינוי גנטי, אלא תלויה בשונות בקצבי החלוקה בתוך האוכלוסייה.
חיידקים העמידים לאנטיביוטיקה
סטאפילוקוקוס זהוב עמיד למתיצילין מוכר החל משנת 1996 כ"חיידק בתי החולים", חיידק זה עמיד בפני כל סוגי האנטיביוטיקה הידועים, ומאיים על כל המאושפזים בבתי החולים, סכנתו כפולה היות שהוא תוקף את החולה במצב בו מערכות ההגנה הרגילות אינן פועלות כראוי. Pseudomonas aeruginosa נפוץ כגורם זיהומים אצל מדוכאי מערכת החיסון ובבתי חולים ואף הוא פיתח עמידות נגד רוב סוגי האנטיביוטיקה הקיימים. בחודש מרץ 2007 התפרסמו ידיעות על תמותה של חולים המאושפזים בבתי חולים בגלל התפרצות החיידק האלים Klebsiella pneumoniae. חיידקים עמידים במיוחד מטופלים באמצעות ליפופפטידים, אך ב-2007 נמצאו חיידקים שפיתחו עמידות גם לטיפול זה.
שיטות לזיהוי עמידות לאנטיביוטיקה
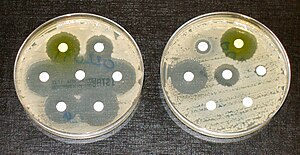
על מנת לטפל בחולים בצורה אופטימלית, קיים צורך לזהות חיידקים עמידים לאנטיביוטיקה. ישנן מספר שיטות מקובלות לזיהוי עמידות. השיטה הנפוצה ביותר מבוססת על גידול החיידקים על מצע המועשר באנטיביוטיקה, כאשר הימצאות מושבות חיידקים על המצע לאחר מספר שעות (לרוב 24) משמעותו שהחיידק עמיד. כיום ישנן גישות מהירות ואוטומטיות שמתבססות על העיקרון הזה ומשמשות בעיקר במוקדי בדיקות גדולים כמו מעבדות של בתי חולים.
שיטות מתקדמות יותר מאפשרות להבחין בגנים לעמידות, כמו הגן לייצור בטא-לקטמאז, ומבוססות על ריצוף או הגברת הרצפים הגנטיים (לדוגמה, באמצעות PCR).
ישנן מספר שיטות נוספות בשלבי פיתוח שונים לזיהוי עמידות לאנטיביוטיקה, וביניהן שימוש בטכנולוגיית MALDI-TOF[5], ספקטרוסקופיית ראמאן[6][7] ו-IR[8], טכנולוגיית DNA Microarray[9][10] ועוד. שיטות אלה מפותחות בעיקר במטרה לקצר את הזמן לזיהוי החיידקים העמידים ובכך לאפשר טיפול מהיר ומדויק יותר בחולים.
עמידות לאנטיביוטיקה בתעשיית בעלי החיים
בשנות ה-40 של המאה ה-20 התגלה שתוספת אנטיביוטיקה למזון בעלי החיים מעלה את קצב הגדילה שלהם, ומאפשרת לצופף יותר בעלי חיים בשטח נתון ללא העלייה הנוספת בתחלואה ותמותה שהייתה נגרמת עקב כך. ב-1951 אישר לראשונה ה-FDA מתן קבוע של פניצלין וכלורטטרציקלין (הטטרציקלין הראשון שזוהה) לבעלי חיים בתוך המזון[11]. פרקטיקה זו מקובלת מאז בעולם בכל סוגי תעשיות המזון מן החי, כולל תעשיית הדגים. בעלי החיים מקבלים אנטיביוטיקה באופן קבוע במינון נמוך תת-תרפויטי בתור זרז גדילה. בנוסף ניתנת לבעלי החיים אנטיביוטיקה כתרופה מונעת במינון רגיל במצבי סיכון מיוחדים כמו גיל הינקות, או כאשר מתגלים תסמיני מחלה אצל פרט אחד וכל הפרטים מקבלים אנטיביוטיקה. מרבית האנטיביוטיקה המיוצרת בעולם מיועדת לתעשיית בעלי החיים, ב-2010 80% מהאנטיביוטיקה בארצות הברית הייתה לשימוש תעשייה זו[12].
סביבה בה אנטיביוטיקה מסוג כלשהו ניתנת במינון נמוך לאורך זמן לפרטים רבים יוצרת לחץ ברירתי (evolutionary pressure) להתפתחות זני חיידקים עמידים לאותו סוג אנטיביוטיקה[13][14].
תכונת העמידות לאנטיביוטיקה עוברת מחיידק לחיידק לא רק על ידי התחלקות אלא גם בהעברה גנטית אופקית, במנגנון זה גן שמעניק עמידות לאנטיביוטיקה מסוימת, עשוי לעבור מחיידק ממין אחד לחיידק ממין אחר ולהקנות לו את אותה עמידות. חיידקים עמידים או גנים של עמידות, יכולים לעבור לחיות אחרות או לאדם על ידי מגע ישיר עם החיות שבתעשייה, מוצרי מזון מחיות אלה, ודרך השפכים של מתקני התעשייה או שדות המדושנים בזבל מתעשייה זו.
החל מסוף העשור 1960 נעשו מחקרים רבים, בעיקר באירופה, על השפעת זרזי גדילה אנטיביוטיים על התפתחות עמידות. נמצא ריכוז גבוה של חיידקים עמידים בבעלי החיים, בפלורה - דהיינו במושבות החיידקים הטבעיות -במעי של עובדי מתקני התעשייה, בני משפחותיהם ואנשים שגרים בסמיכות לשדות שמדושנים בזבל מהתעשייה.
בארצות הברית נעשה מחקר על גנטמיצין (gentamicin), האנטיביוטיקה הנפוצה ביותר שם בלולי פטם מסוג ברוילר. על פי המחקר, בקרב עובדי תעשיית העוף הסיכוי להימצאות Escherichia coli עמיד לגנטמיצין גבוה פי 32 מאשר באוכלוסייה הכללית. יתרה מזאת, עובדי תעשייה זו נמצאו בסיכון גבוה בהרבה להימצאות חיידקים עמידים לטווח רחב של אנטיביוטיקה[15].
החיידק העמיד MRSA (סטאפילוקוקוס זהוב עמיד למתיצילין) פיתח עמידות לכל סוגי הפניצילין והצפלוספורין, שהן התרופות הנהוגות לטיפול בסטאפילוקוקוס זהוב. מחקרים שנעשו בארצות הברית מצאו מושבות של MRSA אצל אנשים הגרים בסמיכות לתעשייה. עם זאת בארצות הברית קיימים חוקים המגבילים גישה למתקני תעשיית בעלי החיים (חוקי אג גאג), לכן החוקרים התקשו לערוך מחקר כלל ארצי על החיידקים בתעשייה זו ולא הגיעו למסקנות נחרצות[16].
MRSA מטופל בעזרת ואנקומיצין, האנטיביוטיקה היחידה שעדיין יכולה לו, אך כבר התפתחו זנים שעמידים גם לואנקומיצין. ואנקומיצין הוא אנטיביוטיקה מקבוצת הגליקופפטידים והוא אסור לשימוש בתעשיית בעלי חיים בגלל חשיבותו לרפואת בני אדם. אך תכשיר אחר מאותה קבוצה, אבופארצין (avoparcin) נפוץ בשימוש כזרז גדילה. מחקר מצא חיידקי Enterococcus עמידים הן לאבופרצין והן לואנקומיצין בחיות קטנות בשתי חוות נפרדות, אף שהחיות לא קיבלו ואנקומיצין. בדיקה גנטית הראתה שרצף הדנ"א מהחוות זהה לזה שבחיידקי Enterococcus מבית החולים. פירוש הדבר שהדמיון במבנה של שתי האנטיביוטיקות מאותה קבוצה, סלל את הדרך גם לעמידות לואנקומיצין[17].
לנוכח גוף המחקר הגדול הקושר בין זרזי גדילה אנטיביוטיים לבין עמידות חיידקים בבעלי חיים ובאדם, אסר האיחוד האירופי עוד ב-2006 על המדינות החברות בו להשתמש באנטיביוטיקה מכל סוג שהוא בתור זרז גדילה. במקומות אחרים בעולם, בין היתר בארצות הברית, בסין וגם בישראל, אין איסור כזה.
על אף הראיות הרבות שנצברו, קשה לעקוב אחרי המסלול שעושים הגנים העמידים מבעלי החיים לחיידקים שמזיקים לבני האדם. קיימת קבוצה עצומה ומגוונת של חיידקים בלתי מזיקים שיכולה לשאת ולהעביר את הגנים. חיידקים אלה הם מאגר נסתר של גני עמידות, ויוצרים מסלולים סבוכים בהם גני עמידות יכולים לעבור אופקית מבעלי החיים ישירות, או בדרך כלל בעקיפין, ולעשות את דרכם לתוך החיידק המסוכן לאדם. עם תנועה כה רבה של גנים בין מארחים שונים, פחות סביר למצוא את אותם חיידקים בדיוק בחיות ובבני אדם, ויותר סביר למצוא את גני העמידות עצמם. ואף גנים אלה עצמם עשויים להשתנות במהלכם דרך המארחים השונים. עד כה המסלולים הנפתלים שעושים הגנים היקשו על הניסיונות להתחקות אחר תנועתם, ולהוכיח את מעבר הגנים העמידים מבעלי חיים לאדם. קושי זה משמש את הלוביסטים של תעשיית בעלי החיים ותעשיית התרופות בארצות הברית כדי לטעון שהראיות הקיימות הן נסיבתיות בלבד, ואין קשר בין תעשיית בעלי החיים לעמידות לאנטיביוטיקה באדם[18][19]. לאור זה בארצות הברית אין הגבלות על השימוש באנטיביוטיקה בתעשיית בעלי החיים אלא המלצות בלבד[20].
בנובמבר 2015 דיווח לראשונה מחקר סיני על ראיות ישירות להעברה אופקית של גן עמידות לאנטיביוטיקה "המוצא האחרון" קוליסטין (colistin) מחזירים לחיידק Escherichia coli בבני אדם[21].
במאי 2016 דווח על מקרה ראשון של הידבקות בחיידק עמיד זה בארצות הברית[22].
העמידות לאנטיביוטיקה בשירות הביוטכנולוגיה
לרוב ביישומי ביוטכנולוגיה של הנדסה גנטית של הגנום בתאים, נוצרת בעיה בהפרדת התאים בהם תהליך שינוי הגנום הצליח מהתאים בהם שינוי הגנום כשל. על מנת להפריד בין תאים אלו, משלבים יחד עם התכונה הרצויה בגנום גם תכונה המעניקה לתא המהונדס גנטית עמידות נגד אנטיביוטיקה מסוימת. לאחר תהליך החדרת החומר הגנטי, התרבית המהונדסת נשטפת בחומר אנטיביוטי ורק התאים בהם ההחדרה צלחה, יישארו חיים עקב העמידות לאנטיביוטיקה שהוחדרה להם.
ראו גם
קישורים חיצוניים
- שרית רוזנבלום, חיידקים עמידים לאנטיביוטיקה מתפשטים בישראל, באתר ynet, 10 בינואר 2010
- ארז גרטי, מנגנוני עמידות לאנטיביוטיקה, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 9 נובמבר 2010
- אירה אייזן, איך נלחמים בחיידקים העמידים בפני אנטיביוטיקה?, באתר וואלה, 3 באפריל 2012
 כרם אביטל, דו"ח: חיות בישראל מקבלות כמות אנטיביוטיקה חריגה, ומסכנות את הצרכן, באתר הארץ, 10 במאי 2015
כרם אביטל, דו"ח: חיות בישראל מקבלות כמות אנטיביוטיקה חריגה, ומסכנות את הצרכן, באתר הארץ, 10 במאי 2015 נטע אחיטוב, עידן האנטיביוטיקה יגיע בקרוב לסופו. הקורונה תיראה אז כמו משחק ילדים, באתר הארץ, 1 באפריל 2021
נטע אחיטוב, עידן האנטיביוטיקה יגיע בקרוב לסופו. הקורונה תיראה אז כמו משחק ילדים, באתר הארץ, 1 באפריל 2021
הערות שוליים
- ↑ הילה אלרואי דה-בר ואלה הר-נוי, חשש להתפרצות חיידק אלים בישראל, באתר nrg, 6 במרץ 2007
- ↑ E. Chain, E. P. Abraham, An Enzyme from Bacteria able to Destroy Penicillin, Nature 146, 1940-12, עמ' 837 doi: 10.1038/146837a0
- ↑ חדשות מדע וטכנולוגיה: בדרך לאנטיביוטיקה מסוג חדש - | הטכניון - מכון טכנולוגי לישראל
- ↑ Database of Cell Signaling and Virtual Journal | Science Signaling, stke.sciencemag.org
- ↑ Antti Vasala, Vesa P. Hytönen, Olli H. Laitinen, Modern Tools for Rapid Diagnostics of Antimicrobial Resistance, Frontiers in Cellular and Infection Microbiology 10, 2020, עמ' 308 doi: 10.3389/fcimb.2020.00308
- ↑ Amir Nakar, Aikaterini Pistiki, Oleg Ryabchykov, Thomas Bocklitz, Detection of multi-resistant clinical strains of E. coli with Raman spectroscopy, Analytical and Bioanalytical Chemistry, 2022-01-04 doi: 10.1007/s00216-021-03800-y
- ↑ Johanna Kirchhoff, Uwe Glaser, Jürgen A. Bohnert, Mathias W. Pletz, Simple Ciprofloxacin Resistance Test and Determination of Minimal Inhibitory Concentration within 2 h Using Raman Spectroscopy, Analytical Chemistry 90, 2018-02-06, עמ' 1811–1818 doi: 10.1021/acs.analchem.7b03800
- ↑ חוקרים ישראלים פיתחו שיטה לאבחון חיידקים עמידים לאנטיביוטיקה, באתר mako, 2021-08-01
- ↑ Noa Wolff, Michaela Hendling, Silvia Schönthaler, Andreas F. Geiss, Low-cost microarray platform to detect antibiotic resistance genes, Sensing and Bio-Sensing Research 23, 2019-04-01, עמ' 100266 doi: 10.1016/j.sbsr.2019.100266
- ↑ Sascha D. Braun, Stefan Monecke, Alexander Thürmer, Antje Ruppelt, Rapid Identification of Carbapenemase Genes in Gram-Negative Bacteria with an Oligonucleotide Microarray-Based Assay, PLOS ONE 9, 28 ביולי 2014, עמ' e102232 doi: 10.1371/journal.pone.0102232
- ↑ Maureen Ogle, Riots, Rage, and Resistance: A Brief History of How Antibiotics Arrived on the Farm, Scientific American Blog Network (באנגלית)
- ↑ Antibiotic Use for Farm Animals - microbewiki, microbewiki.kenyon.edu
- ↑ Tara C. Smith, Livestock-Associated Staphylococcus aureus: The United States Experience, PLOS Pathogens 11, 2015-05-02, עמ' e1004564 doi: 10.1371/journal.ppat.1004564
- ↑ Record-High Antibiotic Sales for Meat and Poultry Production, pew.org
- ↑ Download Limit Exceeded, citeseerx.ist.psu.edu
- ↑ Tara C. Smith, Livestock-Associated Staphylococcus aureus: The United States Experience, PLoS Pathogens 11, 2015-02-05 doi: 10.1371/journal.ppat.1004564
- ↑ Janice Bates, J. Zoe Jordens, David T. Griffiths, Farm animals as a putative reservoir for vancomycin-resistant enterococcal infection in man, Journal of Antimicrobial Chemotherapy 34, 1994-10-01, עמ' 507–514 doi: 10.1093/jac/34.4.507
- ↑ Report: Feeding antibiotics to livestock is bad for humans, but Congress won’t stop it
- ↑ Meat Is Murder—but It’s People Being Killed (and Not How You Think)
- ↑ Stuart B. Levy, Bonnie M. Marshall, Food Animals and Antimicrobials: Impacts on Human Health, Clinical Microbiology Reviews 24, 2011-10-01, עמ' 718–733 doi: 10.1128/CMR.00002-11
- ↑ Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study
- ↑ Discovery of first mcr-1 gene in E. coli bacteria found in a human in United States
| בקטריולוגיה | ||
|---|---|---|
| מונחי יסוד | פרוקריוטים • ארכאונים (חיידקים קדומים) • חיידקים אמיתיים • אנדוטוקסין |  |
| חלקי התא החיידקי ואברוניו | נוקלאואיד • פלסמיד • ציטופלזמה • ריבוזום • קרום התא • דופן התא: פפטידוגליקן (חומצה טיכואית) • פריפלזמה • קרום חיצוני: ליפופוליסכריד • קפסולה ו-Slime layer • שוטון • פילי • פימבריה • ביופילם | |
| מורפולוגיה | נקד • מתג • סלילון | |
| פיזיולוגיה | פליגה • קוניוגציה • טרנספורמציה • עמידות לאנטיביוטיקה | |
| מטבוליזם | חיידקים אירוביים (אווירניים אובליגטוריים, אווירניים פקולטטיביים, מיקרואירופילים) • חיידקים אנאירוביים (אל-אווירניים אובליגטוריים, אל-אווירניים פקולטטיביים, אל-אווירני סובל אוויר) • תסיסה • חיזור סולפט מיקרוביאלי • חיידקים סגולים | |
| שיטות בקטריולוגיות | צביעת גראם (חיידקים גראם-חיוביים, חיידקים גראם-שליליים) • צביעה יציבת חומצה • מבחן קטלאז • מבחן אוקסידאז • מבחן קואגולאז • סיווג לנספילד • מבחן CAMP | |
| מיגור חיידקים | חיטוי • פסטור • עיקור • אנטיביוטיקה | |
עמידות לאנטיביוטיקה34159436Q63391344


