קשר פחמן-פחמן
קשר פחמן-פחמן הוא קשר קוולנטי בין שני אטומי פחמן.[1] הצורה הנפוצה ביותר היא קשר יחיד: קשר המורכב משני אלקטרונים, אחד מכל אטום. קשר פחמן-פחמן יחיד הוא קשר סיגמא ונוצר בין אורביטל מוכלא אחד מכל אחד מאטומי הפחמן. באתאן, האורביטלים הם אורביטלים בעלי הכלאה sp3, אך קשרים יחידים הנוצרים בין אטומי פחמן עם הכלאות אחרות אכן מתרחשים (למשל sp2 ל-sp2). למעשה, אטומי הפחמן בקשר היחיד אינם חייבים להיות מאותה הכלאה. אטומי פחמן יכולים גם ליצור קשרים כפולים בתרכובות הנקראות אלקנים או קשרים משולשים בתרכובות הנקראות אלקינים. קשר כפול נוצר עם אורביטל בעל הכלאה sp2 ואורביטל p שאינו מעורב בהכלאה. קשר משולש נוצר עם אורביטל בעל הכלאה sp2 ושני אורביטלי p מכל אטום. השימוש באורביטלי p יוצר קשר פאי.[2]
שרשראות והסתעפות
פחמן הוא אחד היסודות הבודדים שיכולים ליצור שרשראות ארוכות של אטומים משלהם, תכונה הנקראת קטנציה. שילוב זה עם חוזק הקשר פחמן-פחמן מוליד מספר עצום של צורות מולקולריות, שרבות מהן הן יסודות מבניים חשובים של החיים, כך שלתרכובות פחמן יש תחום מחקר משלהן: כימיה אורגנית.
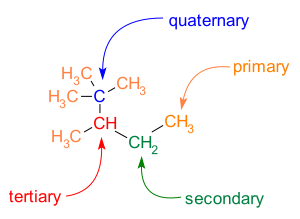
הסתעפות נפוצה גם בשלדים של C-C. אטומי פחמן במולקולה מסווגים לפי מספר שכני הפחמן שיש להם:
- לפחמן ראשוני יש אטום פחמן שכן אחד.
- לפחמן שניוני יש שני אטומי פחמן שכנים.
- לפחמן שלישוני יש שלושה אטומי פחמן שכנים.
- לפחמן רביעוני יש ארבעה אטומי פחמן שכנים.
במולקולות אורגניות מורכבות מבחינה מבנית, הכיוון התלת-ממדי של קשרי פחמן-פחמן באתרים רבעוניים הוא שמכתיב את צורת המולקולה. יתר על כן, אתרים רבעוניים נמצאים במולקולות קטנות פעילות ביולוגית רבות, כגון קורטיזון ומורפין.
סינתזה
תגובות יצירת קשר פחמן-פחמן הן תגובות אורגניות בהן נוצר קשר פחמן-פחמן חדש. הן חשובות בייצור כימיקלים רבים מעשה ידי אדם, כגון תרופות ופלסטיק. התגובה ההפוכה, שבה קשר פחמן-פחמן נשבר, ידועה כאקטיבציית קשר פחמן-פחמן.
כמה דוגמאות לתגובות היוצרות קשרי פחמן-פחמן הן תגובה אלדולית, תגובת דילס-אלדר, תגובת גרינאר, ותגובת ויטיג.
הסינתזה המכוונת של מבנים תלת-ממדיים רצויים עבור אטומי פחמן שלישוניים נפתרה במידה רבה בסוף המאה ה-20, אך אותה יכולת לכוון סינתזת פחמן רביעוני לא החלה להופיע עד העשור הראשון של המאה ה-21.
מקרים קיצוניים
קשרי C-C יחידים, ארוכים וחלשים
זוהו מקרים קיצוניים שונים שבהם קשר C–C מוארך. בדימר גומברג, קשר C–C אחד ארוך למדי, 159.7 פיקומטרים. קשר זה הוא שמתפרק בקלות ובצורה הפיכה בטמפרטורת החדר בתמיסה:[3]
במולקולה הצפופה אף יותר, הקסאקיס(3,5-די-טרט-בוטילפניל)אתאן, אנרגיית פירוק הקשר ליצירת רדיקל טריארילמתיל מיוצב היא רק 8 קלוריות/מול. גם כתוצאה מהצפיפות הסטרית החמורה שלו, להקסאקיס(3,5-די-טרט-בוטילפניל)אתאן יש קשר מרכזי מוארך מאוד באורך של 167 פיקומטר.[4]
קשרי C-C כפולים, חלשים ומפותלים
המבנה של טטראקיס (דימתילאמינו)אתילן (TDAE) מעוות מאוד. הזווית הדיהדרלית עבור שני קצוות ה-N2C היא 28º אף על פי שהמרחק C=C הנורמלי הוא 135 פיקומטר. לטטראאיזופרופילאתילן הכמעט איזו-מבני יש גם מרחק C=C של 135 פיקומטר, אך ליבת ה-C6 שלו היא מישורית.[5]
קשרי C–C משולשים, קצרים וחזקים
בקצה השני, קשר הפחמן-פחמן היחיד המרכזי של דיאצטילן חזק מאוד ב-160 קק"ל/מול, שכן הקשר היחיד מחבר שני אטומי פחמן בעלי הכלאת sp.[6] קשרים מרובים של פחמן-פחמן חזקים יותר בדרך כלל; נקבע כי הקשר הכפול של אתילן והקשר המשולש של אצטילן הם בעלי אנרגיות פירוק קשר של 174 ו-230 קק"ל/מול, בהתאמה.[7] קשר משולש קצר מאוד של 115 פיקומטר נצפה עבור צורוני היודוניום [HC≡C–I+Ph] [–CF3SO3], בשל קבוצת היודוניום המושכת אלקטרונים חזק.[8]
הערות שוליים
- ↑ Dembicki, Harry (2016-10-06). Practical Petroleum Geochemistry for Exploration and Production (באנגלית). Elsevier. p. 7. ISBN 9780128033517.
- ↑ Michael B. Smith, Jerry March, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, John Wiley & Sons, 2007-01-29, מסת"ב 978-0-470-08494-6. (באנגלית)
- ↑ Bochkarev, L. N.; Molosnova, N. E.; Zakharov, L. N.; Fukin, G. K.; Yanovsky, A. I.; Struchkov, Y. T. (1995). "1-Diphenylmethylene-4-(triphenylmethyl)cyclohexa-2,5-diene Benzene Solvate". Acta Crystallographica Section C Crystal Structure Communications. 51 (3): 489–491. doi:10.1107/S0108270194009005.
- ↑ Rösel, Sören; Balestrieri, Ciro; Schreiner, Peter R. (2017). "Sizing the role of London dispersion in the dissociation of all-meta tert-butyl hexaphenylethane". Chemical Science (באנגלית). 8 (1): 405–410. doi:10.1039/c6sc02727j. ISSN 2041-6520. PMC 5365070. PMID 28451185.
- ↑ Bock, Hans; Borrmann, Horst; Havlas, Zdenek; Oberhammer, Heinz; Ruppert, Klaus; Simon, Arndt (1991). "Tetrakis(dimethylamino)ethene: An Extremely Electron-Rich Molecule with Unusual Structure both in the Crystal and in the Gas Phase". Angewandte Chemie International Edition in English. 30 (12): 1678–1681. doi:10.1002/anie.199116781.
- ↑ "NIST Webbook".
- ↑ Blanksby, Stephen J.; Ellison, G. Barney (באפריל 2003). "Bond Dissociation Energies of Organic Molecules". Accounts of Chemical Research (באנגלית). 36 (4): 255–263. CiteSeerX 10.1.1.616.3043. doi:10.1021/ar020230d. ISSN 0001-4842. PMID 12693923.
{{cite journal}}: (עזרה) - ↑ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). Introduction to organic chemistry (4th ed.). Upper Saddle River, N.J.: Prentice Hall. p. 574. ISBN 978-0139738500. OCLC 52836313.
קשר פחמן-פחמן42026125Q1821552



