משוואת נרנסט
באלקטרוכימיה, משוואת נרנסט מגדירה את פוטנציאל האלקטרודה ביחס לפוטנציאל האלקטרודה התקני של זוג האלקטרודות או של חצאי התא של תא אלקטרוכימי. בפיזיולוגיה משמשת משוואת נרנסט למציאת הפוטנציאל החשמלי של קרום התא כאשר הממברנה חדירה ליון אחד . המשוואה קרויה על שם הכימאי הגרמני-פולני חתן פרס נובל לכימיה (1920) ולטר נרנסט אשר ניסח אותה לראשונה.
- הוא קבוע הגזים וערכו
- היא הטמפרטורה, במעלות קלווין.
- היא האקטיביות הכימית בצד המחוזר והמחומצן, בהתאמה.
- הוא קבוע פאראדיי וערכו
- הוא מספר מולי האלקטרונים אשר עוברים בחצי התגובה.
מכיוון שבמקרים רבים התגובה מתרחשת בטמפרטורת החדר, (25 מעלות צלזיוס) ניתן לקצר ולהציב את הערכים של ו- בטמפרטורת החדר, להחליף את הלוגריתם הטבעי בלוגריתם לפי בסיס 10, ולקבל:
- הוא ריכוז המחזר (באיור .
- הוא ריכוז המחמצן.
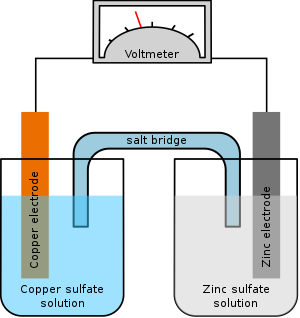
באיור רואים את המתח הנמדד במד המתח (voltmeter) כאשר האלקטרודה הטבולה בתמיסת האבץ (zinc)- היא האנודה והאלקטרודה הטבולה בתמיסת הנחושת (copper) היא הקטודה. זהו פוטנציאל נרנסט (E).
בפיזיולוגיה אנו משתמשים במשוואת נרנסט לחישוב הפוטנציאל בקרום התא כאשר הממברנה חדירה ליון אחד בלבד.
במקרה כזה, בטמפרטורת החדר הערך RT/F יהיה 58. יש לשים לב למטען היון (n שהוא 1 ביון האשלגן או 2 ביון הסידן). כאשר מטען היון הוא הוא שלילי יש לשנות את הסימן לפני הלוגריתם ל (-) (שלילי).
כאשר הממברנה חדירה ליותר מיון אחד נשתמש במשוואת גולדמן-הודג'קין-כץ.
ראו גם
- משוואת גולדמן-הודג'קין-כץ: חישוב מתח קרום תא עם חדירות למספר יונים, שזהו המצב הטבעי בגוף
קישורים חיצוניים
משוואת נרנסט42196783Q751124



