תאוריית ברונסטד–לאורי
תאוריית ברונסטד–לאורי (באנגלית: Brønsted–Lowry acid–base theory; קרויה גם תאוריית הפרוטונים של חומצות ובסיסים[1]) היא תאוריה עבור תגובת חומצה-בסיס (אנ') שהציעו באופן עצמאי יוהאנס ניקולאוס ברונסטד (אנ') ותומאס מרטין לאורי ב-1923[2][3]. הרעיון הבסיסי של תיאוריה זו הוא שכאשר חומצה ובסיס מגיבים זה עם זה, החומצה יוצרת את הבסיס המצומד שלה, והבסיס יוצר את החומצה המצומדת שלו על ידי העברת פרוטון (קטיון המימן, או +H) מהחומצה אל הבסיס.
תאוריית ברונסטד–לאורי היא הכללה של תאוריית ארניוס, שמתארת את אותה התופעה רק בתמיסות מימיות. עם זאת, התיאוריה אינה כוללת תגובות חומצה-בסיס שאינן כרוכות בחילופי פרוטונים, וזו הסיבה שתאוריית החומצה-בסיס של לואיס החליפה אותה.
הגדרה של חומצות ובסיסים
לפי תאוריית ארניוס, אשר קדמה לתאוריית ברונסטד–לאורי, חומצות מוגדרות כחומרים שמתפרקים בתמיסה מימית, כך שנוצרים יוני הידרוניום (H3O+) בעוד שבסיסים מוגדרים כחומרים שמתפרקים בתמיסה מימית ומשחררים יוני הידרוקסיד (OH−) [4][5].
בשנת 1923, הכימאים הפיזיקליים יוהאנס ניקולאוס ברונסטד מדנמרק ותומאס מרטין לאורי מבריטניה הציעו שניהם באופן עצמאי את התיאוריה הנושאת את שמם[6][7][8]. בתאוריית ברונסטד–לאורי, ההגדרה של חומצות ובסיסים נובעת מהאופן שבו הם מגיבים זה עם זה, דבר המאפשר מענה רחב וכללי יותר עבור חומרים שונים[9].
ההגדרה מתבטאת במונחים של ביטוי שיווי משקל:
- חומצה מצומדת + בסיס מצומד ⇌ בסיס + חומצה
באמצעות חומצה HA ובסיס B, ניתן לכתוב את המשוואה באופן סמלי כך:
החץ הדו-כיווני, ⇌, נמצא בשימוש מכיוון שהתגובה יכולה להתרחש הן בכיוון התוצרים והן בכיוון המגיבים[10]. החומצה, HA, יכולה לאבד פרוטון כדי להפוך לבסיס המצומד שלה, −A. הבסיס, B, יכול לקבל פרוטון כדי להפוך לחומצה המצומדת שלו, +HB[11]. רוב תגובות החומצה-בסיס הן מהירות, ולכן רכיבי התגובה נמצאים בדרך כלל בשיווי משקל דינמי זה עם זה[12].
ככל שהחומצה חזקה יותר, כך הבסיס המצומד חלש יותר, ולהפך[א].
אם נסתכל על תגובת הפירוק של חומצה HA, ותגובת הפירוק של החומצה המצומדת של בסיס +HB ועל קבועי הפירוק שלהם:
נראה כי ככל שחומצה חזקה יותר, ערך ה-pKa (האות p מבטאת ו-Ka הוא קבוע הדיסוציאציה של חומצה) שלה נמוך יותר. בתגובת שיווי משקל שבה משתתפים חומצה ובסיס אורגניים, הנטייה של התגובה נקבעת על פי ערכם היחסי של pKa של שתי החומצות בתגובות (הישירה וההפוכה). הכיוון המועדף של התגובה הוא יצירת חומצה חלשה מחומצה חזקה.
בחומצות שבהן האטומים האלקטרושליליים דומים בגודלם, החומצה החזקה ביותר היא זו שבה אטום המימן קשור לאטום האלקטרושלילי ביותר[ב]. לדוגמה, CH3OH חומצי יותר מאשר CH3NH2. כך גם אפקט אינדוקטיבי של משיכת אלקטרונים מגביר חומציות. כשהאלקטרושליליות של הקבוצה מושכת האלקטרונים גדולה יותר, וככל שהיא קרובה יותר לאטום המימן החומצי, כך החומצה חזקה יותר. לדוגמה, FCH2COOH חומצה חזקה יותר מ-ClCH2COOH, משום שפלואור אלקטרושלילי יותר מכלור.
גורם נוסף המשפיע על החומציות הוא הכלאת אורביטלים אטומיים. אורביטלי s קרובים יותר לגרעין מאשר אורביטלי p, לכן ככל שאופי s בקשר עם אטום המימן גבוה יותר בהכלאה, כך הקשר עם אטום המימן קרוב יותר לגרעין, כלומר, אלקטרושלילי יותר, והפרוטון יהיה חומצי יותר. על כן, אטום בעל הכלאה sp הוא אלקטרושלילי יותר מאטום בעל הכלאה של sp2, והאחרון יותר אלקטרושלילי מאטום בעל הכלאה של sp3.
| תרכובת | הכלאה | אחוז s בהכלאה | pKa |
|---|---|---|---|
| C2H6 | sp3 | 25% | 50 |
| C2H4 | sp2 | 33% | 44 |
| C2H2 | sp | 50% | 25 |
אלקטרונים לא מאותרים מייצבים את התרכובות השונות. היבריד רזוננטיבי הוא מיצוע של המבנים הרזוננטיביים השונים הנבדלים זה מזה במיקום זוגות האלקטרונים הלא-קושרים ואלקטרוני ; בסיס בעל אלקטרונים לא מאותרים יציב יותר (חלש יותר) מבסיס דומה בעל אלקטרונים מאותרים.
במידה שהתרכובת נושאת שתי קבוצות חומציות, הבסיס המגיב עמה ירחיק את הפרוטון מהקבוצה החומצית יותר. הוספת אקוויוולנט של בסיס תגרום להרחקת הפרוטון מהקבוצה החומצית השנייה. באופן דומה, כאשר התרכובת נושאת שתי קבוצות בסיסיות, הקבוצה הבסיסית יותר תעבור ראשונה פרוטונציה והוספת אקוויוולנט של חומצה יגרום לפרוטונציה של הקבוצה הבסיסית השנייה.
תמיסות מימיות

בהתחשב בתגובת חומצה-בסיס הבאה:
חומצה אצטית, CH3COOH, היא חומצה מפני שהיא תורמת פרוטון למים (H2O) והופכת לבסיס המצומד שלה, יון האצטט (−CH3COO). H2O הוא בסיס מכיוון שהוא מקבל פרוטון מ-CH3COOH והופך לחומצה המצומדת שלו, יון ההידרוניום (+H3O)[17]. התגובה ההופכית לתגובת חומצה-בסיס היא גם תגובת חומצה-בסיס, בין החומצה המצומדת של הבסיס בתגובה הראשונה לבסיס המצומד של החומצה[18]. בדוגמה לעיל, אצטט הוא הבסיס של התגובה ההופכית ויון הידרוניום הוא החומצה.
מה שקובע איזו משתי התגובות תהיה השלטת הוא, במקרה זה, קבוע הדיסוציאציה של החומצה, שעומד ביחס ישר להיווצרות תוצרים[9].
בכימיה אי אורגנית[19]
המחלקה הגדולה ביותר של חומצות במים מורכבת מצורונים התורמים פרוטונים מקבוצת OH- המחוברים לאטום מרכזי. פרוטון מסוג זה אשר ניתן למסור אותו נקרא פרוטון חומצי כדי להבדיל אותו מפרוטונים אחרים שעשויים להימצא במולקולה, כגון פרוטוני מתיל לא-חומציים ב-CH3COOH.
ישנן שלוש קבוצות של חומצות שיש לקחת בחשבון:
- חומצה מימית, שבה הפרוטון החומצי אשר קיים במולקולת המים, נקשר ליון המתכת המרכזי.
- לדוגמה:
- חומצה הידרוקסידית (hydroxoacid), שבה פרוטון חומצי נמצא בקבוצת הידרוקסיל ללא קבוצת oxo שכנה (O=). דוגמה לכך היא Te(OH)6.
- חומצה חַמְצָנִית[20] (oxoacid), שבה הפרוטון החומצי נמצא על קבוצה הידרוקסילית עם קבוצת oxo מחוברת לאותו אטום. חומצה גופרתית, H2SO4 (O2S(OH)2;5), היא דוגמה לחומצה חמצנית.
חומרים אמפוטריים

המהות של תאוריית ברונסטד-לאורי היא שחומצה קיימת רק ככזו ביחס לבסיס, ולהפך. מים הם אמפוטריים, משמע הם יכולים להגיב הן כחומצה הן כבסיס.
באיוור משמאל, מולקולה אחת של H2O פועלת כבסיס ומקבלת את +H כדי להפוך ל-+H3O בעוד השנייה פועלת כחומצה ומוסרת את +H כדי להפוך ל-−OH[21].
יון המימן (+H), או יון ההידרוניום (+H3O)[ג], הוא חומצת ברונסטד-לאורי בתמיסות מימיות, ויון הידרוקסיד הוא בסיס, מתוקף תגובת הדיסוציאציה העצמית[21].
בתהליך זה, הנקרא "יינון עצמי של מים"[22], כאשר התגובה קדימה (מייננת מים) והתגובה אחורה (יונים נקשרים ליצירת מים) מתרחשות באותו קצב, המערכת נמצאת בשיווי משקל דינמי[23].
תמיסות לא-מימיות
תגובה אנלוגית מתרחשת באמוניה נוזלית:
לפיכך, יון האמוניום, +NH4, ממלא אותו תפקיד באמוניה נוזלית כמו יון ההידרוניום במים, ויון האמיד, -NH2, מקביל ליון הידרוקסיד. מלחי אמוניום מתנהגים כחומצות, ואמידים מתנהגים כבסיסים[24].
ממסים לא-מימיים אחדים יכולים להתנהג כבסיסים, כלומר, מקבלי פרוטונים, ביחס לחומצות ברונסטד-לאורי[25]:
כאשר S מייצג מולקולת ממס. הממסים החשובים ביותר מסוג זה הם דימתיל סולפוקסיד, DMSO, ואצטוניטריל, CH3CN, מכיוון שמבחינה היסטורית ממסים אלו היו בשימוש נרחב למדידת קבועי דיסוציאציה של חומצה עבור מולקולות אורגניות. מאחר ש-DMSO הוא קולט פרוטונים חזק יותר מ-H2O החומצה הופכת לחומצה חזקה יותר בממס זה מאשר במים[26]. ואכן, מולקולות רבות מתנהגות כחומצות בתמיסה לא מימית שאינן עושות זאת בתמיסה מימית. מקרה קיצוני מתרחש עם חומצות פחמן, כאשר מפיקים פרוטון מקשר C-H[27].
ממסים לא-מימיים אחדים יכולים להתנהג כחומצות. ממס חומצי יגביר את הבסיסיות של חומרים המומסים בו. לדוגמה, התרכובת CH3COOH ידועה בתור חומצה אצטית בגלל התנהגותה החומצית במים. עם זאת, התרכובת מתנהגת כבסיס במימן כלורי נוזלי, ממס הרבה יותר חומצי[28].
השוואה עם תאוריית לואיס

באותה השנה בה פרסמו ברונסטד ולאורי את התאוריה שלהם, גילברט ניוטון לואיס הציע תאוריה אלטרנטיבית עבור תגובות חומצה–בסיס. תאוריית לואיס מבוססת על מבנה אלקטרוני (אנ'). בסיס לואיס מוגדר כצורון בעל אורביטל המאוכלס בזוג אלקטרונים לא קושרים שיכול לתרום זוג אלקטרונים לחומצת לואיס, צורון בעל אורביטל ריק מאלקטרונים שיכול לקבל זוג אלקטרונים[29][30][15]. הצעתו של לואיס נותנת הסבר לסיווג ברונסטד–לאורי במונחים של מבנה אלקטרוני.
בתגובה זו מוצגים גם הבסיס, B, וגם הבסיס המצומד, −A, הנושאים זוג בודד של אלקטרונים, והפרוטון, שהוא חומצת לואיס, מועבר ביניהם.
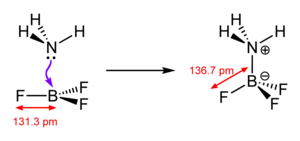
מאוחר יותר, לואיס כתב כי "הגבלה של קבוצת החומצות לאותם חומרים המכילים מימן מהווה התערבות כה גדולה בהבנה הסיסטמטית של הכימיה כמו ההגבלה של המונח "גורם מחמצן" לחומרים המכילים חמצן"[30]. בתאוריית לואיס, חומצה, A ובסיס B, יוצרים תוצר סיפוח AB, שבו זוג האלקטרונים משמש ליצירת קשר קואורדינטיבי בין A ל-B. עניין זה מומחש עם היווצרות תוצר-הסיפוח H3N-BF3 מאמוניה ובורון טריפלואוריד, תגובה שאינה יכולה להתרחש בתמיסה מימית מכיוון שבורון טריפלואוריד מגיב בעוצמה רבה עם מים בתגובת הידרוליזה.
חומצה בורית מוכרת כחומצת לואיס בזכות התגובה הבאה:
במקרה זה, החומצה אינה מוסרת פרוטון, אלא הבסיס, H2O. תמיסה של B(OH)3 היא חומצית מכיוון שיוני מימן משתחררים בתגובה זו[31].
ישנן עדויות מובהקות לכך שתמיסות מימיות מדוללות של אמוניה מכילות כמויות זניחות של יון האמוניום,
וכי כאשר היא מומסת במים, אמוניה מתפקדת כבסיס לואיס[32].
דוגמה לחומר נוסף העומד בהגדרת ברונסטד-לאורי או בהגדרה רחבה יותר, שנמצאת מחוץ לתחום התקפות של ברונסטד-לאורי, ניתן לראות בחומרים אמפוטריים כגון אלומיניום הידרוקסיד, Al(OH)3[33][34]:
- מתנהג כחומצת לואיס בתווך בסיסי, מכיוון שאין חילופי פרוטונים זה עם זה;
- מתנהג כבסיס ברונסטד-לאורי בתווך חומצי.
השוואה לתאוריית לוקס-פלד
בתאוריית לוקס-פלד, תגובות בין תחמוצות במצב נוזלי או מוצק מושוות לתגובות חומצה-בסיס, מה שלא נלקח בחשבון בתאוריית ברונסטד-לאורי. בתאוריה זאת, חומצה מוגדרת כקולטת תחמוצת, בעוד שבסיס יהיה התורם שלה[35]. למשל, התגובה[36]:
מיוצגת באופן כללי על ידי:
תגובה זו אינה עונה על ההגדרה של תאוריית ברונסטד-לאורי לחומצות ובסיסים. מצד שני, תחמוצת המגנזיום (MgO) פועלת כבסיס כאשר היא מגיבה עם תמיסה מימית של חומצה[37].
על פי ברונסטד-לאורי, צורן דו-חמצני (SiO2) המומס במים, אמור להיות חומצה חלשה[38].
לפי תאוריית לוקס-פלד, תרכובות כדוגמת MgO ו-SiO2 בפאזה מוצקה, עשויות להיות מסווגות כחומצות או בסיסים. לדוגמה, המינרל אוליבין עשוי להיחשב כתרכובת של תחמוצת בסיסית, MgO, עם תחמוצת חומצית, סיליקה, SiO2[29].
קישורים חיצוניים
|
עיינו גם בפורטל פורטל כימיה מהווה שער לחובבי הכימיה ולמתעניינים בתחום. בפורטל תוכלו למצוא מידע על כימאים חשובים, על ענפי הכימיה, על ניסויים מעניינים ועוד. |
 חומצות ובסיסים - הגדרה על פי ארניוס, ברונסטד-לאורי, לואיס, סרטון באתר יוטיוב, 17 בדצמבר 2018
חומצות ובסיסים - הגדרה על פי ארניוס, ברונסטד-לאורי, לואיס, סרטון באתר יוטיוב, 17 בדצמבר 2018 סרטון על חומצות הלוגניות, סרטון באתר יוטיוב, 6 במאי 2019
סרטון על חומצות הלוגניות, סרטון באתר יוטיוב, 6 במאי 2019
ביאורים
- ↑ הכינויים "חזק/ה" או "חלש/ה" בהקשר של חומצות ובסיסים מתייחסים לריאקטיביות של אותה מולקולה. חומצת ברונסטד-לאורי חזקה תרצה מאוד למסור פרוטון, ובסיס ברונסטד-לאורי חזק ירצה מאוד לקבל פרוטון. לכן מקטלגים את החומצות והבסיסים ל"יציבים" ו"לא יציבים", כי כאשר החומצה/בסיס חלשים, הם יותר יציבים וינטו להגיב פחות.
- ↑ הסיבה לכך שככל שהאטום אלקטרושלילי יותר אז אטום המימן שמחובר אליו יהיה חומצי יותר נעוצה בכך שכשהפרוטון יעזוב, וישאיר את האטום עם מטען שלילי, אטומים בעלי אלקטרושליליות גבוהה יותר יהיו יציבים יותר. וכאמור, ככל שהבסיס המצומד יציב יותר ככה החומצה חזקה יותר.
- ↑ כדי לפשט את הסימון, מקובל שהיון H3O+ מיוצג בפשטות על ידי H+.
ראו גם
לקריאה נוספת
- Miessler, G. L., Tarr, D. A, Inorganic Chemistry, 5th ed., Pearson Prentice-Hall, 2003
- Armstrong, Fraser, Overton, Tina, Rourke, Jonathan, Weller, Mark, Inorganic Chemistry, 7th ed., Oxford University Press, 2018, מסת"ב 0198835469
- קתרין דניסטון, ג'וזף טופינג, קים וודראם, רוברט קארט, "עולם הכימיה", עמ' 282–287, הוצאת האוניברסיטה הפתוחה, 2017
- דורותה צ'רקי, חוה גל, עליזה עברי, עפר ריעני, "כימיה אורגנית - מדריך למידה: חלק א, פרקים 2-12", הוצאת האוניברסיטה הפתוחה, 2022
הערות שוליים
- ↑ Bronsted-Lowry theory | Definition & Facts | Britannica, www.britannica.com (באנגלית)
- ↑ J. N. Brönsted, Einige Bemerkungen über den Begriff der Säuren und Basen, Recueil des Travaux Chimiques des Pays-Bas 42, 1923, עמ' 718–728 doi: 10.1002/recl.19230420815
- ↑ Society of Chemical Industry, Journal of the Society of Chemical Industry, N/A, 1923
- ↑ Richard L. (Richard Leroy) Myers, The basics of chemistry, Westport, Conn. : Greenwood Press, 2003, מסת"ב 978-0-313-05818-9
- ↑ דניסטון, טופינג, וודראם וקארט, עמ' 282
- ↑ William L. Masterton, Cecile N. Hurley, Edward Neth, Chemistry: Principles and Reactions, Cengage Learning, 2011-01-31, מסת"ב 978-1-133-38694-0. (באנגלית)
- ↑ Darrell Ebbing, Steven D. Gammon, General Chemistry, Enhanced Edition, Cengage Learning, 2010-01-01, עמ' 644, מסת"ב 978-0-538-49752-7. (באנגלית)
- ↑ Armstrong, Overton, Rourke, Weller, p. 150
- ^ 9.0 9.1 Wayback Machine, web.archive.org, 2018-01-07
- ↑ דניסטון, טופינג, וודראם וקארט, עמ' 284
- ↑ דניסטון, טופינג, וודראם וקארט, עמ' 285
- ↑ Mateusz L. Donten, Joost VandeVondele, Peter Hamm, Speed Limits for Acid–Base Chemistry in Aqueous Solutions, CHIMIA 66, 2012-04-25, עמ' 182–186 doi: 10.2533/chimia.2012.182
- ↑ צ'רקי, גל, עברי, ריעני, עמ' 9
- ↑ צ'רקי, גל, עברי, ריעני, עמ' 10
- ^ 15.0 15.1 צ'רקי, גל, עברי, ריעני, עמ' 11
- ↑ צ'רקי, גל, עברי, ריעני, עמ' 12
- ↑ Graham Patrick, Instant Notes in Organic Chemistry, Taylor & Francis, 2004-08-02, מסת"ב 978-1-135-32125-3. (באנגלית)
- ↑ 2.1: Brønsted–Lowry Acids and Bases, Chemistry LibreTexts, 2015-04-23 (באנגלית)
- ↑ Armstrong, Overton, Rourke, Weller, p. 157
- ↑ oxoacid | מונחי האקדמיה, באתר terms.hebrew-academy.org.il
- ^ 21.0 21.1 Amphoterism, web.archive.org, 2019-01-11
- ↑ דניסטון, טופינג, וודראם וקארט, עמ' 287
- ↑ Kristi Lew, Acids and Bases, Infobase Publishing, 2009, עמ' 30, מסת"ב 978-0-7910-9783-0. (באנגלית)
- ↑ Miessler, Tarr, pp. 171-172
- ↑ Wayback Machine, web.archive.org, 2019-09-23
- ↑ Wayback Machine, web.archive.org, 2008-10-09
- ↑ Wayback Machine, web.archive.org, 2019-07-02
- ↑ Armstrong, Overton, Rourke, Weller, p. 153
- ^ 29.0 29.1 Miessler, Tarr, p. 170
- ^ 30.0 30.1 Hall, Norris F. (במרץ 1940). "Systems of Acids and Bases". Journal of Chemical Education. 17 (3): 124–128. Bibcode:1940JChEd..17..124H. doi:10.1021/ed017p124.
{{cite journal}}: (עזרה) - ↑ Acids and Bases: Lewis Acids | Scholars Online Chemistry, www.dorthonion.com
- ↑ Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry (2nd ed.), Prentice Hall, 2004, עמ' 187, מסת"ב 978-0-13-039913-7
- ↑ 1.13: Lewis Acids and Bases - Chemistry LibreTexts, web.archive.org, 2019-09-23
- ↑ Acid-Base Properties of Oxides | Boundless Chemistry, web.archive.org, 2019-04-12
- ↑ Wayback Machine, web.archive.org, 2018-12-22
- ↑ H. Flood, T. Förland, Lars Gunnar Sillén, Annikki Linnasalmi, The Acidic and Basic Properties of Oxides., Acta Chemica Scandinavica 1, 1947, עמ' 592–604 doi: 10.3891/acta.chem.scand.01-0592
- ↑ Wayback Machine, web.archive.org, 2018-08-26
- ↑ Linus Pauling, The nature of the chemical bond and the structure of molecules and crystals : an introduction to modern structural chemistry, Ithaca, N.Y. : Cornell University Press, 1960
תאוריית ברונסטד–לאורי34895425Q556036





